摘要:18.(2009·上海市高中十四校联考)根据①碳原子的电子层结构和每两个原子之间方能形成共用电子对而成为共价键,②烃分子中.每减少两个氢原子会减少两根碳氢键而增加一根碳碳键,③把一对共用电子对作为一根键.碳碳双键则为两根键--.苯环用凯库勒式作讨论.碳原子数用n表示. (1)已知碳的一种同素异形体富勒烯C60.它由六十个碳原子构成.则该物质分子中共有共用电子对数为 . (2)烷烃CnH2n+2中含碳碳键 根.含共价键总数为 . (3)炔烃CnH2n-2中有共价键总数 .其发生某一反应后产物中含有共价键3n根.则发生的反应是 ( ) A.与H2 1?1加成 B.与氯气发生1?2加成 C.与H2O 1?1加成 D.一定数目分子加聚成环状化合物 (4)某烃分子中含有碳碳键数为n+3.则该烃可能为 ( ) A.环烷烃 B.稠环芳香径 C.苯及其同系物 D.二炔烃 [答案] 3n-1 A (4)CD
网址:http://m.1010jiajiao.com/timu3_id_70002[举报]
根据①碳原子的电子层结构和每两个原子之间方能形成共用电子对而成为共价键;②烃分子中,每减少两个氢原子会减少两根碳氢键而增加一根碳碳键;③把一对共用电子对作为一根键,碳碳双键则为两根键……,苯环用凯库勒式作讨论,碳原子数用n表示。
(1)已知碳的一种同素异形体富勒烯C60。有六十个碳原子构成,则该物质分子中共有共用电子对数为 。
(2)那么烷烃CnH2n+2中含碳碳键 根,含共价键总数为 。
(3)炔烃中有共价键数 ,其发生某一反应后产物中含有共价键3n根,则发生的反应是 ( )
A.与H2 1:1加成 B.与氯气发生1:2加成
C.与H2P 1:1加成 D.一定数目分子加聚成环状化合物
(4)某烃分子中含有碳碳键数为n+3,则该烃可能为 ( )
A.环烷烃 B.稠环芳香径 C.苯及其同系物 D.二炔烃
查看习题详情和答案>>根据①碳原子的电子层结构和每两个原子之间方能形成共用电子对而成为共价键;②烃分子中,每减少两个氢原子会减少两根碳氢键而增加一根碳碳键;③把一对共用电子对作为一根键,碳碳双键则为两根键……,苯环用凯库勒式作讨论,碳原子数用n表示。
(1)已知碳的一种同素异形体富勒烯C60。有六十个碳原子构成,则该物质分子中共有共用电子对数为________。
(2)那么烷烃CnH2n+2中含碳碳键________根,含共价键总数为________。
(3)炔烃中有共价键数________,其发生某一反应后产物中含有共价键3n根,则发生的反应是
A.与H2 1:1加成 B.与氯气发生1:2加成
C.与H2P 1:1加成 D.一定数目分子加聚成环状化合物
(4)某烃分子中含有碳碳键数为n+3,则该烃可能为
A.环烷烃 B.稠环芳香径 C.苯及其同系物 D.二炔烃
查看习题详情和答案>>
下表是现行中学化学教科书中元素周期表的一部分,表中的每个字母代表一种短周期元素,请根据要求回答问题.
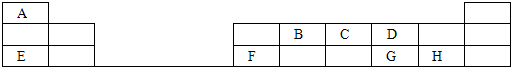
(1)写出B的最高价氧化物的电子式
 ;
;
(2)画出H的原子结构示意图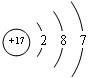
 ;
;
(3)A和G、A和H形成的气态化合物,较稳定的是
(4)D、E的离子半径相比较,较大的是
(5)写出F的单质与E的高价氧化物的水化物反应的方程式
(6)有甲、乙两种化合物均由A、D、E、G四种元素形成,甲、乙的溶液相反应有气体生成,写出该反应的离子方程式
(7)由A、B、C、D四种元素的各一个原子形成的共价分子,每个原子的电子层结构都饱和,写出这种分子可能的结构式
查看习题详情和答案>>

(1)写出B的最高价氧化物的电子式


(2)画出H的原子结构示意图


(3)A和G、A和H形成的气态化合物,较稳定的是
HCl
HCl
(填写化学式);(4)D、E的离子半径相比较,较大的是
O2-
O2-
(填离子符号);(5)写出F的单质与E的高价氧化物的水化物反应的方程式
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
;(6)有甲、乙两种化合物均由A、D、E、G四种元素形成,甲、乙的溶液相反应有气体生成,写出该反应的离子方程式
HSO3-+H+=SO2↑+H2O
HSO3-+H+=SO2↑+H2O
.(7)由A、B、C、D四种元素的各一个原子形成的共价分子,每个原子的电子层结构都饱和,写出这种分子可能的结构式
H-O-C≡N
H-O-C≡N
、H-N=C=O
H-N=C=O
.有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A原子的电子式为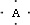 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(1)元素A、B、C、D分别是:A
(2)D元素在周期表中属第
(3)用电子式表示A的气态氢化物的形成过程: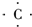 +4H?→
+4H?→
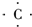 +4H?→
+4H?→ .
.
(4)A和B的单质充分反应生成化合物的电子式是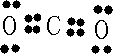
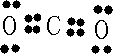 .
.
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明
查看习题详情和答案>>
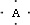 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.(1)元素A、B、C、D分别是:A
碳
碳
,B氧
氧
,C镁
镁
,D铝
铝
.(2)D元素在周期表中属第
三
三
周期ⅢA
ⅢA
族.(3)用电子式表示A的气态氢化物的形成过程:
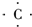 +4H?→
+4H?→
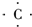 +4H?→
+4H?→
(4)A和B的单质充分反应生成化合物的电子式是
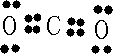
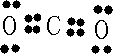
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明
离子化合物
离子化合物
;检验方法为:验证其熔融物是否导电,若导电则为离子化合物,若不导电则为共价化合物
检验方法为:验证其熔融物是否导电,若导电则为离子化合物,若不导电则为共价化合物
.已知A、B、C、D、E、F、G、H是原子序数依次增大的八种元素,A元素是周期表中原子半径最小的元素,B、C和D同周期,E、F和G同周期,A、E 同主族,D、G、H同主族且相邻,B的低价氧化物与C单质分子的电子总数相等,F和G的核电荷数相差4,G的2价简单离子与Ar原子的电子层结构相同.根据以上信息填空:
(1)G元素的二价离子的离子结构示意图为
 ;H的元素符号为
;H的元素符号为
(2)C的气态氢化物空间构型是
(3)据报道,含题中所述元素B、F和Ni三种元素的晶体具有超导性.该晶体的晶胞结构如图,试写出该晶体的化学式

(4)由A、C、D、G四种元素形成的强酸的酸式盐的水溶液中各离子浓度由大到小的顺序为
(5)科学家用C、D、E三种元素形成的化合物ECD3和E2D,在573K时反应制得了离子化合物E3CD4;经测定E3CD4中各原子的最外层电子都达到了8电子稳定结构,则CD43-的电子式为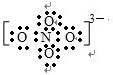
 ,E3CD4与水能剧烈反应转化为常见物质,写出反应的化学方程式:
,E3CD4与水能剧烈反应转化为常见物质,写出反应的化学方程式:
查看习题详情和答案>>
(1)G元素的二价离子的离子结构示意图为


Se
Se
,H元素在周期表中的位置是第四周期第ⅥA族
第四周期第ⅥA族
.(2)C的气态氢化物空间构型是
三角锥形
三角锥形
;A和B形成的四原子非极性分子的结构式是H-C≡C-H
H-C≡C-H
.(3)据报道,含题中所述元素B、F和Ni三种元素的晶体具有超导性.该晶体的晶胞结构如图,试写出该晶体的化学式
MgCNi3
MgCNi3

(4)由A、C、D、G四种元素形成的强酸的酸式盐的水溶液中各离子浓度由大到小的顺序为
c(H+)>c(SO42-)>c(NH4+)>c(OH-)
c(H+)>c(SO42-)>c(NH4+)>c(OH-)
.(5)科学家用C、D、E三种元素形成的化合物ECD3和E2D,在573K时反应制得了离子化合物E3CD4;经测定E3CD4中各原子的最外层电子都达到了8电子稳定结构,则CD43-的电子式为


Na3NO4+H2O═NaNO3+2NaOH
Na3NO4+H2O═NaNO3+2NaOH
.