网址:http://m.1010jiajiao.com/timu3_id_69565[举报]
A:
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为
(2)写出基态Cu+的核外电子排布式
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为
(4)写出与CO互为等电子体的离子
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子轨道的杂化类型分别为
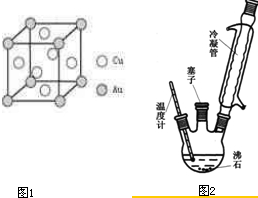
(6)铜金合金形成的晶胞如图1所示,其中Cu、Au原子个数比为
B:
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到.
实验室可利用如图2实验装置合成对氨基苯磺酸.实验步骤如下:
1在一个250mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18mL浓硫酸.
2将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5h.
③将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品.
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干.(说明:100mL水在20℃时可溶解对氨基苯磺酸1.08g,在100℃时可溶解6.67g.)
试回答填空.
(1)装置中冷凝管的作用是
(2)步骤②中采用油浴加热,下列说法正确的是
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是
(1)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为__________________,多余的氯气可用绿矾吸收,反应的离子方程式为____________________________________________________________________。
(2)氯气用于自来水消毒除有异味外,近来发现能产生500多种有致癌、致畸作用的有机氯衍生物,如CHCl3、CCl2Br2等。写出CH4与Cl2反应生成CHCl3的化学方程式:
__________________;__________________;__________________。
以上反应均属于_________反应(填有机反应类型),由此可知,每生成1 mol CHCl3,消耗Cl2的物质的量_________ (填“大于”“等于”或“小于”)3 mol。
(3)用高铁酸钠(Na2FeO4)对来自河、湖的淡水消毒是城市饮用水处理新技术,下列对Na2FeO4能用于饮用水消毒和净化处理的原因分析正确的是( )
A.Na2FeO4在溶液中显强碱性,能消毒杀菌
B.Na2FeO4的还原产物是Fe3+,易水解生成Fe(OH)3,可使水中悬浮物凝聚沉降
C.Na2FeO4的还原产物是Fe2+,易水解为Fe(OH)2,可使水中悬浮物凝聚?沉降
D.Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
高铁(Ⅵ)酸盐是新一代水处理剂,其制备方法有次氯酸盐氧化法(湿法):该法是在碱性溶液中,利用次氯酸盐氧化三价铁盐,试写出并配平这一离子反应方程式:__________________。
(4)我国南方某些地区的井水取来久置后,由澄清透明变成有少量棕红色絮状沉淀沉积于缸底,水面浮着一层“锈皮”,当地居民常采用加明矾的方法处理。①井水久置后,水面浮着的一层“锈皮”的主要成分是_________(写化学式)。②用化学方法鉴别该井水的步骤是__________________;离子方程式是__________________。③用化学方法鉴别经明矾处理后的水的步骤是__________________;离子方程式是__________________。④AlCl3·6H2O(代号AC)和[Al2(OH)nCl6-n]m(代号BAC)都可以作为水澄清剂。它们对水的pH改变的影响是否一样大?_________;原因是什么?__________________。
(5)X物质也可用于自来水消毒,既能提高消毒效率,又安全、无异味、无副作用,该物质在自然界中存在,对地球生物起保护伞作用。X的化学式是_________。X能使湿润的淀粉碘化钾试纸变蓝,试写出该反应的化学方程式:__________________。该反应过程中氧化产物和还原产物的物质的量之比为_________。
(6)ClO2被称为“第四代”饮用水杀菌剂,因其高效、无污染而被广泛使用。我国北京永利科技有限公司已用电解法批量生产ClO2。其反应原理为![]() +4 H+
+4 H+![]() 4ClO2↑+O2↑+2H2O,从反应原理看,应在酸性条件下进行,能否用盐酸调节溶液的酸性?
4ClO2↑+O2↑+2H2O,从反应原理看,应在酸性条件下进行,能否用盐酸调节溶液的酸性?
答:________(填“能”或“不能”),理由是________________________________。
查看习题详情和答案>>37.在化学反应中,铜元素可表现为0、+1、+2价。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜〔即:曾青(CuSO4)跟铁反应就生成铜〕。试写出该反应的化学方程式: 。
(2)铜器表面有时会生成铜绿〔Cu2(OH)2CO3〕,这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的反应的化学方程式: 。
(3)新制的铜试剂〔Cu2(OH)2〕与葡萄糖反应会生成红色沉淀,因此该试剂可用于检验糖尿病人尿液中葡萄糖的含量。葡萄糖的结构简式如下:![]() (简写为GCHO)
(简写为GCHO)
试写出GCHO与Cu(OH)2反应的化学方程式: 。
38.目前,我国铜矿集中分布在长江中下游和云南省,读5、6图回答:

图5
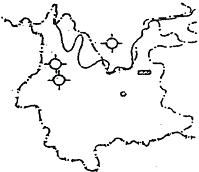
图6
(1)图中A、B、C三个铜矿产地的名称分别是 、 、 。
(2)铜矿的品位一般在1%左右,故粗铜冶炼在布局上必须 。云南省长期向省外输出粗铜,近年充分利用省内的 资源,在省会兴建了精炼(电解)铜的大型企业,实现了有色金属冶炼的产业升级。
39.铜和氮、磷、钾一样,也是植物必需的矿质元素。根吸收矿质元素的过程与呼吸作用密切相关,因为呼吸作用为矿质元素的离子从土壤溶液进入根细胞内提供 和 。
40.铜钱在历史上曾经是一种广泛流通的货币。
(1)试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1183.4℃,铁的熔点是1534.8℃。)
(2)清代采取银、钱并用的货币制度。百姓出卖劳动产品得到的是铜钱,按市场比价合成白银向国家纳税。清中期以前,银钱比价基本平稳(1两白银=1000文铜钱)。鸦片战争之前以及战后,银钱比价从1000文持续攀升至1300文、1400文、1600文甚至更高,出现空前严重的银荒(银贵钱贱)。试分析其原因及社会影响。
查看习题详情和答案>>37.在化学反应中,铜元素可表现为0、+1、+2价。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即:曾青(CuSO4)跟铁反应就生成铜]。试写出该反应的化学方程式: 。
(2)铜器表面有时会生成铜绿[Cu2(OH)2CO3],这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的反应的化学方程式: 。
(3)新制的铜试剂[Cu2(OH)2]与葡萄糖反应会生成红色沉淀,因此该试剂可用于检验糖尿病人尿液中葡萄糖的含量。葡萄糖的结构简式如下:![]() (简写为GCHO)
(简写为GCHO)
试写出GCHO与Cu(OH)2反应的化学方程式: 。
38.目前,我国铜矿集中分布在长江中下游和云南省,读图8、9回答。

图8

图9
(1)图中A、B、C三个铜矿产地的名称分别是 、 。
(2)铜矿的品位一般在1%左右,故粗铜冶炼在布局上必须 。云南省长期向省外输出粗铜,近年充分利用省内的 资源,在省会兴建了精炼(电解)铜的大型企业,实现了有色金属冶炼的产业升级。
39.铜和氮、磷、钾一样,也是植物必需的矿质元素。根吸收矿质元素的过程与呼吸作用密切相关,因为呼吸作用为矿质元素的离子从土壤溶液进入根细胞内提供 和 。
40.铜钱在历史上曾经是一种广泛流通的货币。
(1)试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1183.4℃,铁的熔点是1534.8℃。)
(2)清代采取银、钱并用的货币制度。百姓出卖劳动产品得到的是铜钱,按市场比价折合成白银向国家纳税。清中期以前,银钱比价基本平稳(1两白银=1000文铜钱)。鸦片战争之前以及战后,银钱比价从1000文持续攀升至1300文、1400文、1600文甚至更高,出现空前严重的银荒(银贵钱贱)。试分析其原因及社会影响。
查看习题详情和答案>>
(1)请在上图中描出金属与非金属的分界线,并将铁元素所在族的位置全部涂黑.
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第VIIA族,理由是:氢的最外层电子“饱和缺一”.请用电子式表示LiH:______.
(3)f与c或g均能形成一些化合物,据有关材料f与c能形成化合物fC6,f能与g形成化合物f2g.请回答下面问题:
①甲同学通过分析认为fC6此物质不可在O2中燃烧,原因是______.
②乙同学通过分析认为F2g2是分子晶体,试写出其结构简式:______;
该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的反应方程式:______.
(4)a和f形成化合物a2f,a2f分子中f原子轨道的杂化类型为______,a2f分子空间构型为______.
(5)下列叙述正确的是______
A.h的最高价氧化物对应的水化物是一种强碱.
B.硒化氢的稳定性强于f的氢化物的稳定性.
C.c与h形成化合物的水溶液显中性.
D.离子半径:f>g>h>d
E.f与d形成离子化合物为电解质,故该晶体能导电.
F.a、d、e常见氧化物熔沸点高低比较:e>d>a.