摘要:(四)脱水反应 CH3CH2OH CH2=CH2↑+H2O 2CH3CH2OH CH3CH2O CH3CH2 +H2O HCOOH CO↑+H2O
网址:http://m.1010jiajiao.com/timu3_id_69502[举报]
醇脱水反应在不同温度条件下得到的产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.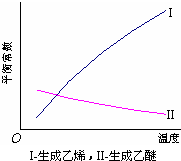
已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃.试回答:
(1)乙醇脱水制乙烯的反应是 (填“放热”、“吸热”)反应,若在上述实验条件下,增大压强,平衡 (选填“正向”、“逆向”、“不”)移动;
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式 .当乙醇起始浓度相同时,平衡常数K值越大,表明 (填序号);
A.乙醇的转化率越高 B.反应进行得越完全
C.达到平衡时乙醇的浓度越大 D.化学反应速率越快
(3)根据表中数据分析,为了又快又多地得到乙醚,反应的合适温度区域是 .选择该温度区域的理由是 .
查看习题详情和答案>>

| 温度 (℃) |
乙醇转化率 (%) |
有机产物含量 (体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 115 | 20 | 8.7 | 90.2 |
| 135 | 68 | 16.7 | 82.2 |
| 155 | 88 | 32.3 | 66.8 |
| 175 | 90 | 86.9 | 12.1 |
(1)乙醇脱水制乙烯的反应是
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式
A.乙醇的转化率越高 B.反应进行得越完全
C.达到平衡时乙醇的浓度越大 D.化学反应速率越快
(3)根据表中数据分析,为了又快又多地得到乙醚,反应的合适温度区域是
下列说法不正确的是( )
| A、煤经过气化和液化等物理变化可以转化为清洁燃料 | B、侯氏制碱法的工艺过程,应用了物质溶解度的差异 | C、食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同 | D、甘氨酸和丙氨酸发生脱水反应,最多可生成4种二肽 |
(2010?南通模拟)工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下: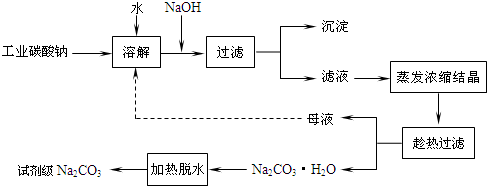
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示: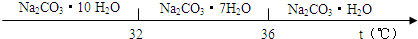
(1)加入NaOH溶液时发生的离子反应方程式为
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)
(3)“趁热过滤”时的温度应控制在
(4)已知:Na2CO3?10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ?mol-1
Na2CO3?10H2O(s)=Na2CO3?H2O(s)+9H2O(g)△H=+473.63kJ?mol-1
写出Na2CO3?H2O脱水反应的热化学方程式
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行
查看习题详情和答案>>

已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
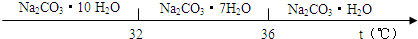
(1)加入NaOH溶液时发生的离子反应方程式为
Fe3++3OH-=Fe(OH)3↓
Fe3++3OH-=Fe(OH)3↓
、MgCO3+2OH-=Mg(OH )2↓+CO32-
MgCO3+2OH-=Mg(OH )2↓+CO32-
.(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)
Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强
Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强
.(3)“趁热过滤”时的温度应控制在
高于36℃
高于36℃
.(4)已知:Na2CO3?10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ?mol-1
Na2CO3?10H2O(s)=Na2CO3?H2O(s)+9H2O(g)△H=+473.63kJ?mol-1
写出Na2CO3?H2O脱水反应的热化学方程式
Na2CO3?H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol
Na2CO3?H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol
.(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行
不可行
不可行
,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质
若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质
.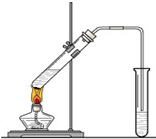 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:(1)乙醇、乙酸分子中的官能团分别是
羟基
羟基
、羧基
羧基
(2)装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
倒吸
倒吸
.(3)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是
防止暴沸
防止暴沸
.(4)该反应属于哪类反应类型
BDE
BDE
.A.加成反应 B.取代反应 C.水解反应 D.酯化反应 E.可逆反应
(5)写出制取乙酸乙酯的化学反应方程式
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
| 浓硫酸 |
| △ |
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
.| 浓硫酸 |
| △ |
(6)无水乙酸又称冰醋酸(熔点16.6℃).在室温较低时,无水乙酸就会凝结成像冰一样的晶体.请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸?
水浴微热、用热毛巾热敷
水浴微热、用热毛巾热敷
.(7)乙醇在一定条件下还能发生脱水反应产生乙烯.乙烯通入溴的四氯化碳溶液中,观察到的现象是
溴水颜色褪去
溴水颜色褪去
;其反应方程式为CH2=CH2+Br-Br→CH2Br-CH2Br
CH2=CH2+Br-Br→CH2Br-CH2Br
.此外,乙烯能用来生产环氧乙烷,生产工艺主要有两种:
工艺一:
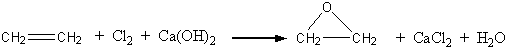
工艺二:
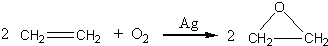
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,因此,在实际生产中,应采用
工艺二
工艺二
(填“工艺一”或“工艺二”)更环保、更经济.