摘要:18..碱式氯化铝[Al2(OH)nCl6-n]m .是一种比Al2(SO4)3效果更好的净水药剂.以下是用煤矸石(主要含Al2O3.SiO2及少量铁的氧化物)为原料生产碱式氯化铝过程中遇到的情况: ⑴在反应器中加入16%的硫酸和16%的盐酸.在不断搅拌过程中再加入经过焙烧后的煤矸石粉.反应器上部有一条长管子作为反应时气体的排放管.加热至沸腾并保持一段时间.期间不断用精密pH试纸在排气管口上方检查排出气体的pH.记录如下: 时间 起始 14min后 30min后 75min后 pH <2.0 =2.5 <3.5 =3.5 试解释排气管中放出气体的pH变化的原因.如果把排气管加长一倍.排气的pH有无变化?为什么? , ⑵观察反应器内溶液的颜色.在沸腾1h内.溶液逐渐呈黄绿色.以后逐渐转变为淡棕黄色.1.5h后呈棕红色.解释导致颜色变化的原因. ⑶上述反应结束后.冷却.过滤弃渣.然后再加热至100℃.并在不断搅拌的条件下.向溶液慢慢地添加Ca(OH)2至适量.生成大量沉淀.过滤上述溶液.弃渣.得到澄清的BAC稀溶液.将此稀溶液加热蒸发浓缩.又产生白色细晶状沉淀.经化验分析.知此沉淀不是BAC固体.也不是AlCl3晶体或Al(OH)3.问:这是什么物质?为什么此时会有沉淀析出? ⑷铁的化合物和铝的化合物一样也可作净水药剂,此外,溶液中元素Fe还能与CN-形成特定的络合物.某溶液中同时存在Fe(CN)63-和Fe(CN)64-两种离子.H2O2可使它们相互转化.请用离子方程式表示这种转化. 酸性条件: 碱性条件:
网址:http://m.1010jiajiao.com/timu3_id_68861[举报]
2010年上海世博会主题是“城市,让生活更美好”,试回答下列问题:
(1)为确保世博会期间申城空气质量优良率达到95%以上,世博会期间的空气质量状况监测中,不需要监测的指标是
a.可吸入颗粒物(PM10)b.NO2浓度 c.SO2浓度 d.CO2浓度;
(2)造成臭氧层空洞的主要物质是
(3)为2010年世博会期间提供科学有效的环境质量保障方案,白龙港污水处理厂升级改造,处理废水时加入K2SO4?Al2(SO4)3?24H2O或碱式氯化铝的作用是
(4)世博会中国馆--“东方之冠”,它由钢筋混凝土、7000多块红色铝板和1200多块玻璃等建成.生产玻璃所用的工业设备是
查看习题详情和答案>>
(1)为确保世博会期间申城空气质量优良率达到95%以上,世博会期间的空气质量状况监测中,不需要监测的指标是
d
d
.a.可吸入颗粒物(PM10)b.NO2浓度 c.SO2浓度 d.CO2浓度;
(2)造成臭氧层空洞的主要物质是
氟里昂(氯氟代烃、溴氟代烃等)
氟里昂(氯氟代烃、溴氟代烃等)
.为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量.对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为2NO+2CO
N2+2CO2
| ||
2NO+2CO
N2+2CO2
.
| ||
(3)为2010年世博会期间提供科学有效的环境质量保障方案,白龙港污水处理厂升级改造,处理废水时加入K2SO4?Al2(SO4)3?24H2O或碱式氯化铝的作用是
混凝剂
混凝剂
;通入臭氧或二氧化氯的作用是消毒剂
消毒剂
.某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
.(4)世博会中国馆--“东方之冠”,它由钢筋混凝土、7000多块红色铝板和1200多块玻璃等建成.生产玻璃所用的工业设备是
玻璃窑
玻璃窑
;石英玻璃化学稳定性强、膨胀系数小,是一种特种玻璃,石英玻璃的主要成分是SiO2
SiO2
.聚合氯化铝是一种用途广泛的生活和工业污水处理剂,其单体是[Al2(OH)nCl6-n](1≤n≤6)(碱式氯化铝,商品名“BAC”).以下是实验室用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料获得碱式氯化铝的主要实验步骤.
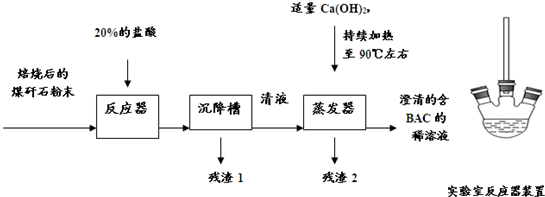
试回答下列问题:
(1)向蒸发器中加入适量Ca(OH)2主要目的是
(2)持续加热并保持90℃左右是为了
(3)残渣2的主要成分可能是
(4)实验中不断用精密pH试纸在反应器上方的排气管口检测,测得pH的变化趋势为
(5)为了定量测定所得的含BAC稀溶液中BAC的含量,你建议可以测量的项目有
查看习题详情和答案>>

试回答下列问题:
(1)向蒸发器中加入适量Ca(OH)2主要目的是
调节溶液的溶液的pH
调节溶液的溶液的pH
.(2)持续加热并保持90℃左右是为了
促进铝盐的水解
促进铝盐的水解
.你建议的加热方式为水浴加热
水浴加热
.(3)残渣2的主要成分可能是
Fe(OH)3
Fe(OH)3
,请另用实验来证明你的结论(填操作与现象)取少许残渣2于小试管中,加适量盐酸溶解,滴加KSCN溶液,溶液呈红色
取少许残渣2于小试管中,加适量盐酸溶解,滴加KSCN溶液,溶液呈红色
.(4)实验中不断用精密pH试纸在反应器上方的排气管口检测,测得pH的变化趋势为
由小到大至基本恒定
由小到大至基本恒定
.(填“由小到大至基本恒定”、“由大到小至基本恒定”或“一直保持恒定”)(5)为了定量测定所得的含BAC稀溶液中BAC的含量,你建议可以测量的项目有
测定碱式氯化铝中铝元素的含量
测定碱式氯化铝中铝元素的含量
.利用某炉渣(只含Fe2O3、FeO、SiO2、Al2O3)可制备新型净水剂碱式氯化铝[Al2(OH)nCl6-n] 和Fe2O3。工艺流程如下:
①用3.00mol/L的盐酸稀盐酸 浸取炉渣,过滤.
浸取炉渣,过滤.
②滤液先用H2O2氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3
③将第②步分离出沉淀的滤液通CO2调pH值后,保持温度在90~100℃进行“蒸发浓缩”,可以得到碱式氯化铝[Al2(OH)nCl6-n]
据以上信息回 答下列问题:
答下列问题:
(1)实验室配制3.00mol/L的盐酸100mL需要36.5%的浓盐酸(密度为1.2g/cm 3) _____mL,配制用到的仪器有烧杯、玻璃棒、量筒、胶头滴管、 。
3) _____mL,配制用到的仪器有烧杯、玻璃棒、量筒、胶头滴管、 。
(2)写出H2O2与滤液反应的化学方程式
(3) “蒸发浓缩”需保持温度在90~100℃,可采用的加热方法是
(4)为验证炉渣中含有Fe2O3,做如下实验:
a取适量炉渣于烧杯中,加足量 溶解、静置
b取上层清液少量于试管中,滴加 ,观察现象。选用提供的试剂,
提供的试剂:①稀硝酸 ②稀硫酸 ③氯水 ④ KMnO4溶液 ⑤ KSCN溶液
KMnO4溶液 ⑤ KSCN溶液
步骤a、b中所加试剂分别为 ;
步骤b中反应的离子方程式: