摘要:2.混和气体→F-C- B →A→F→C
网址:http://m.1010jiajiao.com/timu3_id_68722[举报]
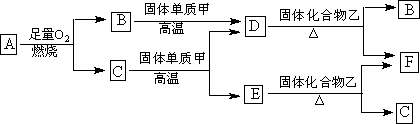
气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数。常温下B、D、E是常见气体,C是液体;单质甲中有含X元素;固体乙是氧化物。各物质有如下图所示的转化关系。

试回答下列问题:
(1)若气体A是纯净物,且A分子的空间构型为直线型,则A的电子式为 。
(2)若气体A是混合气体,且X与Y的质量比小于3,则气体A中肯定有 (写化学式)。
(3)C与固体甲在高温下反应的化学方程式为 。
(4)气体D与化合物乙在加热下反应的化学方程式为 。
(5)若F与C在一定条件下还可以生成固体乙和气体E,请写出该反应的化学方程式 。
查看习题详情和答案>>
| |||||||||||||||||||
A装置中装有淡黄色的固体,分液漏斗中装有浓盐酸,B中盛浓硫酸,C中放有催化剂,D中盛淀粉碘化钾溶液,E中盛足量的NaOH溶液,F中盛FeSO4和H2SO4混合溶液.
先打开止水夹,通入N2,待装置中空气被赶尽后关闭止水夹,点燃酒精灯:从分液漏斗放入浓盐酸,D中溶液迅速变蓝,F中溶液由浅绿色变为棕黄色(整个装置无O3).
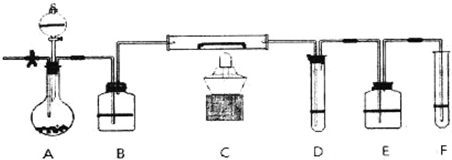
(1)淡黄色固体所含化学键的名称为:
(2)如何检查装置的气密性
(3)C中反应的化学方程式
(4)E装置中反应的离子方程式
(5)如F中仍有Fe2+,如何检验含有Fe2+
查看习题详情和答案>>
先打开止水夹,通入N2,待装置中空气被赶尽后关闭止水夹,点燃酒精灯:从分液漏斗放入浓盐酸,D中溶液迅速变蓝,F中溶液由浅绿色变为棕黄色(整个装置无O3).

(1)淡黄色固体所含化学键的名称为:
离子键、共价键
离子键、共价键
;装有遮黄色的固体仪器的名称圆底烧瓶
圆底烧瓶
.(2)如何检查装置的气密性
关闭止水夹,将F中的导管伸入水槽中,用酒精灯给圆底烧瓶微热,导管口有气泡产生,冷却后,导管出现水柱
关闭止水夹,将F中的导管伸入水槽中,用酒精灯给圆底烧瓶微热,导管口有气泡产生,冷却后,导管出现水柱
.(3)C中反应的化学方程式
4HCl+O2
2Cl2+2H2O
| ||
| △ |
4HCl+O2
2Cl2+2H2O
.
| ||
| △ |
(4)E装置中反应的离子方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(5)如F中仍有Fe2+,如何检验含有Fe2+
取F中少量溶液于小试管中,滴加一滴高锰酸钾溶液,高锰酸钾溶液褪色,说明含有Fe2+
取F中少量溶液于小试管中,滴加一滴高锰酸钾溶液,高锰酸钾溶液褪色,说明含有Fe2+
.A、B、C、D、E是由短周期元素组成的六种常见物质.已知:
①常温下均呈气态,其中B、C、F为单质;
②实验室制取B时,用排饱和食盐水法收集可减少B的水中的溶解;
③A与B反应生成C和D,A的水溶液呈碱性,D的水溶液呈酸性;
④C与F在放电条件下反应生成E,E遇空气变色.
回答下列问题:
(1)A的电子式是 ,实验室制取B的化学方程式为 .
(2)A的水溶液呈碱性的原因是 (结合化学用语说明),将等物质的量浓度、等体积的A、D溶液混合,所得溶液中离子浓度由大到小依次排列为 .
(3)一定条件下A与F反应可生成C和一种无色无味液体,该反应中氧化剂与还原剂的物质的量之比为 .
(4)组成C、B两物质的元素,按原子个数1:3形成化合物G,G是一种淡黄色液体,遇水即发生水解可生成一种具有漂白性的物质,写出反应的方程式 ;该反应说明组成C、B两物质的元素中非金属性较强的是 .(填元素符号)
查看习题详情和答案>>
①常温下均呈气态,其中B、C、F为单质;
②实验室制取B时,用排饱和食盐水法收集可减少B的水中的溶解;
③A与B反应生成C和D,A的水溶液呈碱性,D的水溶液呈酸性;
④C与F在放电条件下反应生成E,E遇空气变色.
回答下列问题:
(1)A的电子式是
(2)A的水溶液呈碱性的原因是
(3)一定条件下A与F反应可生成C和一种无色无味液体,该反应中氧化剂与还原剂的物质的量之比为
(4)组成C、B两物质的元素,按原子个数1:3形成化合物G,G是一种淡黄色液体,遇水即发生水解可生成一种具有漂白性的物质,写出反应的方程式