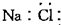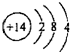摘要:2.虚拟方程式:CO+Na2O2¾®Na2CO3.H2+Na2O2¾®2NaOH.答案为C.
网址:http://m.1010jiajiao.com/timu3_id_68672[举报]
(2009?泰安模拟)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.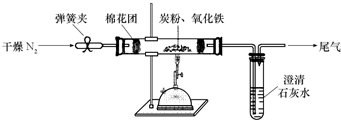
(1)提出假设:该反应的气体产物全部是二氧化碳.
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(3)查阅资料:氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.请写出该反应的离子方程式
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气,然后冷却至室温,称得硬质玻璃管和固体总质量为52.24g.
(5)数据处理:经计算,参加反应的碳元素质量为0.48g,氧元素质量为0.96g.得出原假设不成立,理由是
(6)得出结论:根据数据处理结果判断,反应产生的气体是,该实验中发生反应的化学方程式为
(7)实验优化:根据实验得出的结论应对该实验装置进一步完善,请你从下图所示装置中选取必要装置,对实验加以改进

查看习题详情和答案>>

(1)提出假设:该反应的气体产物全部是二氧化碳.
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(3)查阅资料:氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.请写出该反应的离子方程式
NH4++NO2-=N2↑+2H2O
NH4++NO2-=N2↑+2H2O
.(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气,然后冷却至室温,称得硬质玻璃管和固体总质量为52.24g.
(5)数据处理:经计算,参加反应的碳元素质量为0.48g,氧元素质量为0.96g.得出原假设不成立,理由是
反应后的气体中碳、氧原子的物质的量之比为2:3,与二氧化碳中碳、氧原子的物质的量比不相符
反应后的气体中碳、氧原子的物质的量之比为2:3,与二氧化碳中碳、氧原子的物质的量比不相符
.(6)得出结论:根据数据处理结果判断,反应产生的气体是,该实验中发生反应的化学方程式为
CO和CO2;2C+Fe2O3
2Fe+CO↑+CO2↑
| ||
CO和CO2;2C+Fe2O3
2Fe+CO↑+CO2↑
.
| ||
(7)实验优化:根据实验得出的结论应对该实验装置进一步完善,请你从下图所示装置中选取必要装置,对实验加以改进
在原装置最后连接上C装置
在原装置最后连接上C装置
.
 (2013?朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
(2013?朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.(1)用化学方程式表示NO形成硝酸型酸雨的反应
2NO+O2═2NO2、3NO2+H2O═2HNO3+NO
2NO+O2═2NO2、3NO2+H2O═2HNO3+NO
(2)能作脱除剂的物质很多,下列说法正确的是
ab
ab
a.用 H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用 Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
(3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2.
Ⅰ.已知可通过下列方法合成尿素:
2NH3(g)+CO2(g)?H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)?CO(NH2)2(s)+H2O(l)△H=+28.5kJ/mol
①尿素释放出NH3的热化学方程式是
CO(NH2)2(s)+H2O(l)?2NH3(g)+CO2(g)△H=+131kJ/mol
CO(NH2)2(s)+H2O(l)?2NH3(g)+CO2(g)△H=+131kJ/mol
②写出有利于尿素释放NH3的条件并说明理由
升高温度;升高温度有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行
升高温度;升高温度有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行
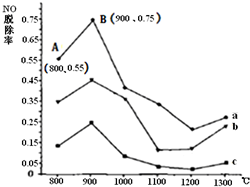
Ⅱ.CO(NH2)2与某种烟气(主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
①曲线a 对应CO(NH2)2 与NO的物质的量比值是
3:1
3:1
.②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是
4NH3+6NO═5N2+6H2O或2CO(NH2)2+6NO═2CO2+4H2O+5N2
4NH3+6NO═5N2+6H2O或2CO(NH2)2+6NO═2CO2+4H2O+5N2
.③900℃~1200℃区间内脱除率下降,NO浓度上升.发生的主要反应是
4NH3+5O2═4NO+6H2O
4NH3+5O2═4NO+6H2O
.④曲线a中,NO的起始浓度为6×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
1.5×10-4
1.5×10-4
mg/(m3?s).(2012?许昌三模)碳及其化合物的研究具有重要的现实意义.
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
请完成并配平上述化学方程式.
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).
下表所列数据是在不同温度下的化学平衡常数(K)
①在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应,5分钟后测得c(CO)=0.4mol/L,算此段时间的反应速率(用H2表示)
②由表中数据判断上述合成甲醇反应的△H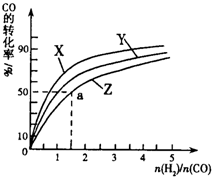
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系请回答:
(Ⅰ)在上述三种温度中,曲线Z对应的温度是
(Ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=
④一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳.写出该电池负极发生反应的电极方程式
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
查看习题详情和答案>>
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
3
3
C+2
2
K2Cr2O7+8
8
H2SO4
H2SO4
→3
3
CO2↑+2
2
K2SO4+2
2
Cr2(SO4)3+8
8
H2O请完成并配平上述化学方程式.
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).
下表所列数据是在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.0 | 0.27 | 0.012 |
0.24
0.24
mol/(L?min);②由表中数据判断上述合成甲醇反应的△H
<
<
0(填“>”、“<”或“=”)
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系请回答:
(Ⅰ)在上述三种温度中,曲线Z对应的温度是
270℃
270℃
;(Ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=
4L2?mol-2
4L2?mol-2
.④一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳.写出该电池负极发生反应的电极方程式
CH3OH+H2O═CO2+6H++6e-
CH3OH+H2O═CO2+6H++6e-
.(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
1.6×10-5mol/L
1.6×10-5mol/L
.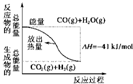 CO(g)与H2O(g)反应过程的能量变化如图所示,有关两者反应说法正确的是( )
CO(g)与H2O(g)反应过程的能量变化如图所示,有关两者反应说法正确的是( )