摘要:4.2N2H4(g)+2NO2(g)¾®3N2(g)+4H2O(g)+534×2+67.2 kJ. 数轴法巧解
网址:http://m.1010jiajiao.com/timu3_id_68618[举报]
Ⅰ.盖斯定律内容:
如图所示
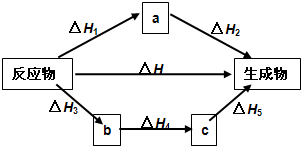
△H=
Ⅱ.(5分)若已知 H2(g)+1/2O2(g)=H2O(g)△H1=-241.8kJ/mol
H2O(g)=H2O(l)△H2=-44.0kJ/mol
求反应H2(g)+1/2O2(g)=H2O(l) 的焓变△H3可分两步
①在方框中填上化学式及状态

②求△H3
Ⅲ.(3分)已知在卫星发射时可用肼(N2H4)为燃料,NO2作氧化剂,二者反应生成N2和气态H2O(g).又知:
1/2N2(g)+O2(g)=NO2(g)△H1=+33.8kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol ②
写出2N2H4+2NO2=3N2+4H2O反应的热化学方程式
查看习题详情和答案>>
对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的
对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的
也就是说反应焓变(反应热效应)只与初始状态
初始状态
、终了状态
终了状态
有关,与反应过程
反应过程
无关.如图所示

△H=
△H1+△H2
△H1+△H2
=△H3+△H4+△H5
△H3+△H4+△H5
Ⅱ.(5分)若已知 H2(g)+1/2O2(g)=H2O(g)△H1=-241.8kJ/mol
H2O(g)=H2O(l)△H2=-44.0kJ/mol
求反应H2(g)+1/2O2(g)=H2O(l) 的焓变△H3可分两步
①在方框中填上化学式及状态

②求△H3
△H1+△H2
△H1+△H2
=-285.8kJ/mol
-285.8kJ/mol
(求具体数值)Ⅲ.(3分)已知在卫星发射时可用肼(N2H4)为燃料,NO2作氧化剂,二者反应生成N2和气态H2O(g).又知:
1/2N2(g)+O2(g)=NO2(g)△H1=+33.8kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol ②
写出2N2H4+2NO2=3N2+4H2O反应的热化学方程式
N2H4 (g)+3/2NO2(g)=N2(g)+2H2O(g)△H=-567.8kJ/mol
N2H4 (g)+3/2NO2(g)=N2(g)+2H2O(g)△H=-567.8kJ/mol
.
2003年10月15日我国成功发射了第一艘载人航天飞船——“神舟”五号,2005年10月12日“神舟”六号飞船成功发射,完成了多人多天飞行,从此我国进入了航天大国和航天强国行列,实现了中华民族自古以来的飞天梦想。发射飞船时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应方程式为:2N2H4+2NO2====3N2+4H2O。下列说法错误的是( )
A.可以用湿润的KI淀粉试纸检验Br2蒸气和NO2气体
B.NO2是污染大气的主要气体之一
C.N2H4分子中N元素的化合价为-2
D.N2H4和NH3的性质相似,能与强酸反应
查看习题详情和答案>>