网址:http://m.1010jiajiao.com/timu3_id_68310[举报]
(1)A的含氧官能团名称为
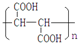
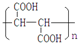
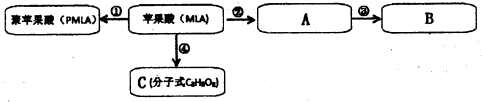
(2)①②③④四个转化中属于酯化反应的是
(3)聚苹果酸(PMLA)含单碳支链,它具有良好的生物相容性,可望作为手术缝合线等材料应用于生物医药和生物材料领域.其在生物体内水解的化学方程式为


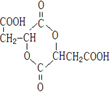
(4)C是苹果酸分子间脱水形成的含六元环的化合物,C的结构简式为



①含醇羟基②能与FeCl3溶液发生显色反应③能与NaHCO3溶液反应产生CO2.
回答下列问题:
(1)N的电子式为


(2)D与E以1:1形成的化合物与水反应的化学反应方程式
(3)A、B、C、D可形成阳离子和阴离子个数比是1:1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1:2加热反应,写出反应的化学方程式
| ||
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质.则其负极反应为
(5)在一定温度下,将4mol C单质和12mol A单质通入到体积为2L的密闭容器中,发生反应,2min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为
| 4 |
| 27 |
| 4 |
| 27 |
a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质.
已知:
(1)0.1mol苹果酸与足量NaHCO3溶液反应能产生4.48L CO2(标准状况);
(2)苹果酸脱水生成能使溴水褪色的产物;
(3)R-CH2-COOH
| Cl2 |
| 催化剂 |

RCH2Br
| ①NaCN |
| ②H2O,H+ |

请回答:
(1)写出实验室制乙烯的化学方程式
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
(2)E的核磁共振氢谱有三组峰,其峰面积比为1:2:2,E的结构简式为
(3)写出MLA所含官能团的名称
(4)写出一种与MLA具有相同官能团的同分异构体的结构简式


(5)检验D中是否含有氯元素的方法是:取少量D于试管中,
(6)写出C与NaOH溶液反应的化学方程式
(7)PMLA具有良好的生物相容性,可作为手术缝合线等材料应用于生物医药和生物材料领域.其在生物体内水解的化学方程式
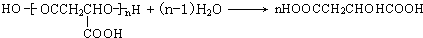
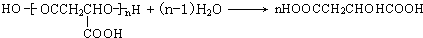
(12分)某芳香族化合物A的结构简式是 (其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
(其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
(1)E的分子式是 。
(2)关于上述各步转化中,下列说法正确的是 。
a. 以上各步没有涉及加成反应 b. E比C的相对分子质量小18
c. A、B、C、D中都含有—COOH
d . A与C发生酯化反应后得到的有机物分子式可能是C18H18O4Cl
(3)写出所有符合下列要求的E的同分异构体的结构简式:
(①分子中苯环上有三个取代基,且苯环上的一氯代物有两种②1 mol该有机物与足量银氨溶液反应能产生4 mol Ag)。
(4)针对以下不同情况分别回答:
①若E能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成F;D能发生银镜反应。则D的结构简式是 。欲由A通过一步反应得到F,该反应的化学方程式是 。
②若E中除苯环外,还含有一个六元环,则C→E的化学方程式是 。
(10分)榴石矿石可以看作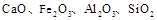 组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
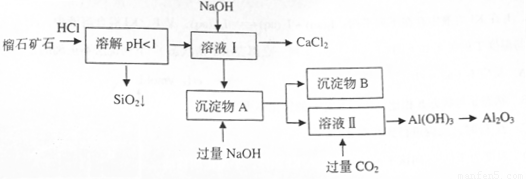
(1)榴石矿加盐酸溶解后,溶液里除了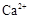 外,还含有的金属离子是
。
外,还含有的金属离子是
。
(2)对溶液I进行操作时,控制溶液PH=9~10(有关氢氧化物沉淀的PH见下表)
NaOH不能过量,若NaOH过量可能会导致 溶解, 沉淀。

(3)写出向沉淀物A中加入过量氢氧化钠溶液的离子方程式 。
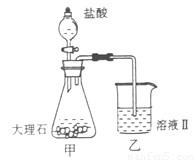
(4)①某同学在实验室中用图I装置制取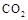 气体并通入溶液II中,结果没有沉淀产生,可能的原是
;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为
。
气体并通入溶液II中,结果没有沉淀产生,可能的原是
;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为
。
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
查看习题详情和答案>>