网址:http://m.1010jiajiao.com/timu3_id_67627[举报]
 A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:(1)将E的单质投入水中,发生反应的离子方程式为
(2)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是
(3)化学反应3A2(g)+C2(g)?2CA3(g).△H=-92.4kJ?mol-1
①当反应达到平衡时不断改变条件(不改变A2、C2和CA3的 量),如图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是
②温度为T℃时,将5mol A2和2mol C2放入0.5L密闭容器中,平衡后测得C2的转化率为50%,计算反应的平衡常数为
(4)已知0.4mol 液态C2 A4与液态双氧水反应,生成C2和液态水,放出327.2kJ的热量.1mol液态水变为水蒸气需吸收44.0kJ的热量.写出液态C2 A4与液态双氧水反应,生成C2和水蒸气的热化学方程式
已知A、B、C、D、E、F六种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
元素 性质或结构信息
A 单质常温下为固体,难溶于水易于溶CS2。能形成2种二元含氧酸。
B 原子的M层有1个未成对的p电子。核外p电子总数大于7。
C 单质曾被称为“银色的金子”。与锂形成的合金常用于航天飞行器。单质能溶强酸和强碱。
D 原子核外电子层上s电子总数比p电子总数少2个。单质和氧化物均为空间网状晶体,具有很高的熔、沸点。
E 其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高。
F 周期表中电负性最大的元素
(1)A原子的最外层电子排布式 ,D原子共有 种不同运动状态的电子。
(2)F与E元素第一电离能的大小关系: > (填元素符号)。
(3)A,B两元素的氢化物分子中键能较小的是 ;分子较稳定的是 。(填分子式)
(4)C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为_________________。
(5)F与钙可组成离子化合物,其晶胞结构如图所示,该化合物的电子式是 。已知该化合物晶胞1/8的体积为2.0×10-23cm3,求该离子化合物的密度,请列式并计算(结果保留一位小数):_______________________。

查看习题详情和答案>>
| 元素 | 性质或结构信息 |
| A | 单质常温下为固体,难溶于水易于溶CS2。能形成2种二元含氧酸。 |
| B | 原子的M层有1个未成对的p电子。核外p电子总数大于7。 |
| C | 单质曾被称为“银色的金子”。与锂形成的合金常用于航天飞行器。单质能溶强酸和强碱。 |
| D | 原子核外电子层上s电子总数比p电子总数少2个。单质和氧化物均为空间网状晶体,具有很高的熔、沸点。 |
| E | 其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高。 |
| F | 周期表中电负性最大的元素 |
(1)A原子的最外层电子排布式 ,D原子共有 种不同运动状态的电子。
(2)F与E元素第一电离能的大小关系: > (填元素符号)。
(3)A,B两元素的氢化物分子中键能较小的是 ;分子较稳定的是 。(填分子式)
(4)C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为_________________。
(5)F与钙可组成离子化合物,其晶胞结构如图所示,该化合物的电子式是 。已知该化合物晶胞1/8的体积为2.0×10-23cm3,求该离子化合物的密度,请列式并计算(结果保留一位小数):_______________________。

(1)A、C元素可以形成多种化合物,其中甲是火箭推进剂中常用的液态燃料,甲中A、C元素的质量比为7:1。已知0.4mol液态甲和氧气完全反应生成氮气和液态水放出248.8kJ的热量,写出该反应的热化学方程式____________ 。
(2)在直接以液态甲为燃料的电池中,电解质溶液为NaOH溶液,负极的反应式为___________,理想状态下,该燃料电池消耗1mol液态甲所能产生的最大电能为528.7kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
(3)A、B、D元素可以形成化合物乙,其化学式为A2B2D4,0.2mol/L的乙溶液和0.2mol/L的NaOH溶液等体积混合,所得溶液显酸性,则该溶液中各离子浓度由大到小排列的顺序为_______________ 。
(4)将8mL 0.1mol/L的酸性高锰酸钾溶液和2mL 1.0mol/L的乙溶液在试管中混合,将试管置于25℃水中(如下图所示)。KMnO4浓度随时间变化关系如下图所示。

②计算前40秒用乙表示的平均反应速率,v(乙)______________;
③40s~65s的反应速率比前40s快,解释原因_______________ 。
2012年冬季,我国城市空气污染状况受到人们的强烈关注,其中NOx、CO、SO2是主要污染性气体。
I.汽车内燃机工作时发生的反应 是导致汽车尾 气中含有NO的重要原因之一。
是导致汽车尾 气中含有NO的重要原因之一。
(1)有人欲选用合适的催化剂,使反应2NO(g)=N2(g)+O2(g)能较快进行以达到除去NO的目的。你认为该反应能否自发进行 (填“能”或“不能”)。
(2)利用催化技术可将汽车尾气中的NO气体转化成无毒气体,相关反应的平衡常数可表示为
 ,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表
,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表

①根据土表数据计算0~4s间用NO表示的平均速率v(NO)= ;达到化学平衡时两种反应物的转化率是否相等 (填“相等”或“不相等”)。
②在5~6s时,若K增大,5s后正反应速率 (填“增大”或“减小”)
③在5~6s时,若K不变,以上各物质的物质的量变化原因可能是 。
A.选用更有效的催化剂 B.缩小容器的体积
C.降低CO2浓度 D.升高温度
II为探究硫在氧气中燃烧的产物里是否有SO3,某化学兴趣小组在绝热环境下进行了定量实验探究。探究实验的相关数据如下
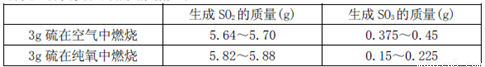
(3)对数据进行分析可知,等质量的硫在纯氧中燃烧产生的SO3比在空气中燃烧产生的SO3 (填“多”或“少”),原因可能是 。
A.纯氧中氧气浓度高,有利于化学平衡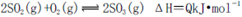 向右移动
向右移动
B.化学反应
C.纯氧中氧气浓度高,单位时间内发热量大,致使反应体系的温度较高,不利于化学平衡
 向右移动
向右移动
D.3g硫在纯氧中燃烧比3g硫在空气中燃烧放出的热量多,不利于化学平衡
 向右移动
向右移动
查看习题详情和答案>>