题目内容
2012年冬季,我国城市空气污染状况受到人们的强烈关注,其中NOx、CO、SO2是主要污染性气体。
I.汽车内燃机工作时发生的反应 是导致汽车尾 气中含有NO的重要原因之一。
是导致汽车尾 气中含有NO的重要原因之一。
(1)有人欲选用合适的催化剂,使反应2NO(g)=N2(g)+O2(g)能较快进行以达到除去NO的目的。你认为该反应能否自发进行 (填“能”或“不能”)。
(2)利用催化技术可将汽车尾气中的NO气体转化成无毒气体,相关反应的平衡常数可表示为
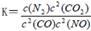 ,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表
,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表

①根据土表数据计算0~4s间用NO表示的平均速率v(NO)= ;达到化学平衡时两种反应物的转化率是否相等 (填“相等”或“不相等”)。
②在5~6s时,若K增大,5s后正反应速率 (填“增大”或“减小”)
③在5~6s时,若K不变,以上各物质的物质的量变化原因可能是 。
A.选用更有效的催化剂 B.缩小容器的体积
C.降低CO2浓度 D.升高温度
II为探究硫在氧气中燃烧的产物里是否有SO3,某化学兴趣小组在绝热环境下进行了定量实验探究。探究实验的相关数据如下

(3)对数据进行分析可知,等质量的硫在纯氧中燃烧产生的SO3比在空气中燃烧产生的SO3 (填“多”或“少”),原因可能是 。
A.纯氧中氧气浓度高,有利于化学平衡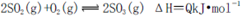 向右移动
向右移动
B.化学反应
C.纯氧中氧气浓度高,单位时间内发热量大,致使反应体系的温度较高,不利于化学平衡
 向右移动
向右移动
D.3g硫在纯氧中燃烧比3g硫在空气中燃烧放出的热量多,不利于化学平衡
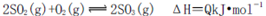 向右移动
向右移动
(14分)
能 (2分)
①0.0225mol·L-1·s-1(2分);不相等(2分)
②减小(2分)
③BC(2分)
(3)少(2分);BC(2分)
【解析】
试题分析:
(1)该反应是放热反应,能自发进行。
(2)①v(NO)=△c/△t=0.0225mol·L-1·s-1;两物质的起始量不同,转化量相同,所以转化率不同。
②该反应是放热反应,只有温度下降才能使K增大,温度下降v减小。
③分析数据,平衡应该正向移动,A.使用催化剂不改变平衡,错误;D.升高温度,K改变,错误。
(3)对数据进行分析可知,等质量的硫在纯氧中燃烧产生的SO3比在空气中燃烧产生的SO3少,用BC项内容可以解释。
考点:本题以科学情景为基础,考查了化学反应的方向、限度,化学平衡的移动、计算、平衡常数知识。
