网址:http://m.1010jiajiao.com/timu3_id_67285[举报]
氯及其化合物是中学化学中的重要研究对象之一。
(1)在实验室中常用二氧化锰和浓盐酸制取氯气,写出有关反应的离子方程式______________________;
(2)实验室也可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若用该反应制取标准状况下1.344 L氯气,反应过程中转移电子的物质的量为_________;
(3)某同学用排空气法收集一瓶氯气并进行氯气与铁反应的实验:取一根细铁丝,用砂纸将铁丝擦至光亮,用坩埚钳夹住,在酒精灯上烧至红热,铁丝保持红热,然后立即伸入充满氯气的集气瓶中,观察到的现象是______________________。向反应后的集气瓶中加入适量的蒸馏水,振荡,然后向所得溶液中滴加亚硫酸钠溶液,再滴加氯化钡溶液发现溶液变浑浊。写出上述反应的离子方程式:___________________ 、_____________________。
查看习题详情和答案>>
氯及其化合物是中学化学中的重要研究对象之一。
(1)在实验室中常用二氧化锰和浓盐酸制取氯气,写出有关反应的离子方程式__________
____________________________________________________________________________;
(2)实验室也可以利用如下反应制取氯气![]() :。若用该反应制取标准状况下1.344 L氯气,反应过程中转移电子的物质的量为_________;
:。若用该反应制取标准状况下1.344 L氯气,反应过程中转移电子的物质的量为_________;
(3)某同学用排空气法收集一瓶氯气并进行氯气与铁反应的实验:取一根细铁丝,用砂纸将铁丝擦至光亮,用坩埚钳夹住,在酒精灯上烧至红热,铁丝保持红热,然后立即伸入充满氯气的集气瓶中,观察到的现象是______________________。向反应后的集气瓶中加入适 量的蒸馏水,振荡,然后向所得溶液中滴加亚硫酸钠溶液,再滴加氯化钡溶液发现溶液变浑 浊。写出上述反应的离子方程式:___________________ 、_____________________。
查看习题详情和答案>>(08上海松江区模拟)在研究硝酸的性质时,某班级学生做了如下三个实验:
实验一:试管中加入铜片和浓硝酸,片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
实验二:试管中加入铜片和稀硝酸(可适当加热),片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
实验三:试管中加入红热的木炭和浓硝酸,片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
问:
(1)实验三现象
(2)实验一中发生反应的离子方程式
(3) 实验二中硝酸的作用是
(4)若用铜来制取硝酸铜溶液,采用什么方法方法较好?(写出化学方程式)
(5)若把硝酸铜溶液制成硝酸铜晶体,应考虑哪些问题?
。
查看习题详情和答案>>(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g),△H=+131.3kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+CO2(g)?2CO(g),△H=+172.5kJ?mol-1
则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H=
(3)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)?CH3OH(g).甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极通入的物质是:
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所x需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨.合成氨反应原理为:N2(g)+3H2(g)
| 一定条件 |
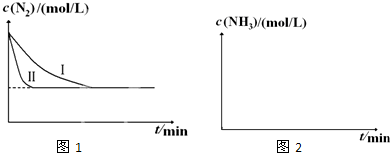
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图
(1)甲同学取两束细铜丝用砂纸打磨后在酒精灯上灼烧至红热,再分别迅速伸入盛满O2或Cl2的两个集气瓶中.其中能看到燃烧现象的集气瓶中所装气体是
(2)乙同学为验证Fe在冷的浓HNO3中发生钝化,但能和热的浓HNO3反应,设计了如图所示的实验,请你指出其中的两处主要错误:①
| 1 |
| 3 |
| 1 |
| 3 |
(3)丙同学将乙同学的Fe和浓HNO3反应后的溶液冷却,再将溶液倒人烧杯中并加入一块Cu片,发现Cu片逐渐溶解.
①丙同学依据反应中某一现象得出了乙同学实验后HNO3过量的正确结论,他依据的反应现象是
②丙同学认为铜片溶解可能还有另一化学反应的存在原因,该反应的离子方程式是
(4)丁同学取0.05molOi与足量浓HNO3反应,采用了正确的试验方法,但收集产生的气体不足0.1mol,最有可能的原因是(用化学方程式表示)
