摘要: 某国的自来水厂很多是用Cl2来杀菌消毒的.但是Cl2对人体有害.很多国家已经不再使用.而改用一种叫做铁酸钠的物质(Na2FeO4).关于该物质的说法正确的是 A. 利用铁酸钠杀菌消毒是因为它溶于水产生一种胶体 B. 利用铁酸钠杀菌消毒是因为它具有强氧化性 C. 该物质中.铁的化合价为 +3 D. 该物质中.铁的化合价为 +6
网址:http://m.1010jiajiao.com/timu3_id_66843[举报]
下列有关说法中正确的是( )
| A、自来水厂可用明矾对水进行消毒杀菌 | B、氯碱工业中,NaOH是在阴极室中产生的 | C、电解法精炼铜时,粗铜接电源的负极 | D、实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用玻璃塞 |
(2006?南充一模)某中学“水情况监测与分析”化学兴趣小组测定某河流中氧的含量;经查阅有关资料了解到溶解氧测定可用“碘量法”,有关原理用如下方程式表示:
a.MnSO4+2NaOH═Mn(OH)2↓+Na2SO4
b. Mn(OH)2+
Mn(OH)2+ O2--H2MnO3
O2--H2MnO3
c.H2MnO3+Mn(OH)2═MnMnO3+2H2O
d.MnMnO3具有氧化性,在酸性条件下可与KI发生反应:
 MnMnO3+
MnMnO3+ H2SO4+
H2SO4+ KI---
KI--- MnSO4+
MnSO4+ I2+
I2+ H2O+
H2O+ K2SO4
K2SO4
(1)请配平b和d两方程式.b
(2)然后用
(3)在仪器准备中有容量瓶、量筒、移液管、锥形瓶、铁架台,为完成实验,还缺少的必要仪器是
(4)他们在三处取样,A处于河流上游的自来水厂取水口处,B处在距某有机物生产厂排污口不远处,C处在河流的下游.测得三个结果:4.60mg?L-1、8.09mg?L-1、8.19mg?L-1,请判断4.60mg?L-1是在
(5)取100mL水样,用n mol?L-1的Na2S2O3溶液进行滴定,当最后一滴Na2S2O3溶液滴入锥形瓶时,溶液颜色由
查看习题详情和答案>>
a.MnSO4+2NaOH═Mn(OH)2↓+Na2SO4
b.
 Mn(OH)2+
Mn(OH)2+ O2--H2MnO3
O2--H2MnO3c.H2MnO3+Mn(OH)2═MnMnO3+2H2O
d.MnMnO3具有氧化性,在酸性条件下可与KI发生反应:
 MnMnO3+
MnMnO3+ H2SO4+
H2SO4+ KI---
KI--- MnSO4+
MnSO4+ I2+
I2+ H2O+
H2O+ K2SO4
K2SO4(1)请配平b和d两方程式.b
2,1,2
2,1,2
d1,3,2,2,1,3,1
1,3,2,2,1,3,1
(填配平的计量数).(2)然后用
淀粉
淀粉
作指示剂,用硫代硫酸钠标准溶液滴定析出的碘(2Na2S2O3+I2═2NaI+Na2S4O6).根据上述物质间存在的关系,即可计算出溶解氧的量.(3)在仪器准备中有容量瓶、量筒、移液管、锥形瓶、铁架台,为完成实验,还缺少的必要仪器是
碱式滴定管
碱式滴定管
.(4)他们在三处取样,A处于河流上游的自来水厂取水口处,B处在距某有机物生产厂排污口不远处,C处在河流的下游.测得三个结果:4.60mg?L-1、8.09mg?L-1、8.19mg?L-1,请判断4.60mg?L-1是在
B
B
(填“A”、“B”或“C”)处水样中溶解氧的数据.(5)取100mL水样,用n mol?L-1的Na2S2O3溶液进行滴定,当最后一滴Na2S2O3溶液滴入锥形瓶时,溶液颜色由
蓝色
蓝色
变为无色
无色
,消耗V mL Na2S2O3溶液,则溶解氧的浓度为80Vn
80Vn
mg?L-1(用V、n表示).ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图:
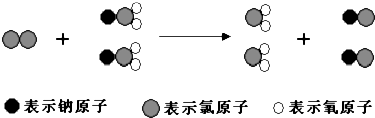
下列有关该反应的叙述中正确的是( )

下列有关该反应的叙述中正确的是( )
| A、该反应是复分解反应 | B、NaClO2和ClO2中Cl的化合价相同 | C、该反应涉及的物质中只含有极性键和离子键 | D、该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl |
