题目内容
(14分)金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4。它是空间技术、航海、化工、医疗上不可缺少的材料。
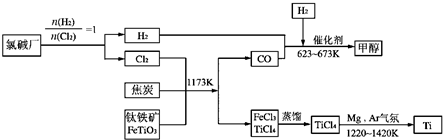
Ⅰ.工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如下图(部分产物略去):
(1)步骤①反应的化学方程式为:2FeTiO3 + 6C + 7Cl2 2FeCl3 + 2TiCl4 + 6CO,还原剂是 。
2FeCl3 + 2TiCl4 + 6CO,还原剂是 。
(2)步骤②分离出TiCl4的方法,利用了TiCl4与FeCl3 的不同。
(3)步骤④反应的化学方程式为________________________________,该反应在氩气中进行的理由是________________________ ______。
(4)绿色化学提倡物料循环。以上流程中,可用于循环的物质除Cl2、Mg外,还有____________。
II. 工业上也可用TiO2通过下述两种方法制备金属钛:
方法一:先将TiO2氯化为TiCl4,再还原得到Ti。
(5)氯化反应TiO2 (s ) +2Cl2 (g)
) +2Cl2 (g)  TiCl4(l) + O2 (g) 无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因: 。
TiCl4(l) + O2 (g) 无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因: 。
方法二:以熔融盐为电解液电解TiO2获得Ti。其中,碳块为阳极,电极反应式为:2O2ˉ– 4eˉ=O2↑;TiO2作阴极,被还原。
(6)阴极的电极反应式为 。
(7)电解过程中需定期向电解槽中加入碳块的原因是 。
(14分)
(1) FeTiO3、C(2分)
FeTiO3、C(2分)
(2)沸点(1分)
(3)2Mg + TiCl4 2MgCl2 + Ti ;防止Mg、Ti被氧化(各2分,共4分)
2MgCl2 + Ti ;防止Mg、Ti被氧化(各2分,共4分)
(4)MgCl2(1分)
(5)碳单质与氧气反应减小产物浓度,平衡不断向右移动,使反应顺利进行(2分)
(6)TiO2+4eˉ=Ti+2O2ˉ(2分)
(7)碳与阳极产生的氧气反应而不断消耗(2分)
解析

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案



 2FeCl3 + 2TiCl4 + 6CO,还 原剂是 ,每生成1mol TiCl4转移 mol电子。
2FeCl3 + 2TiCl4 + 6CO,还 原剂是 ,每生成1mol TiCl4转移 mol电子。