摘要:(江苏省南京市2010届高三第二次模拟考试.6)A.B.C.D.E.F为原子序数依次增大的短周期元素.其中A与E同主族.B与F同主族.E与F同周期.已知常温下A.E单质的状态不同.D原子的核电荷数是B原子最外层电子数的2倍.F单质是一种重要的半导体材料.下列说法正确的是( ) A.原子半径由达到小的顺序是: B.由A.C.D三种元素组成的化合物中可能含有离子键 C.F.C.B元素最高价氧化物对应的水化物的酸性依次增强 D.F与D形成的化合物质地坚硬.既不与酸反应也不与碱反应 高频考点八 电化学问题
网址:http://m.1010jiajiao.com/timu3_id_66634[举报]
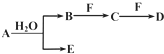 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:(1)若常温下A为有色气体.
①当F是一种金属单质时,请写出一定浓度的B溶液和适量F反应生成C与气体E的离子方程式
②当C为直线型分子时,E具有漂白性,物质F焰色反应呈黄色,则C的电子式为
(2)若A为淡黄色固体,D为白色难溶于水的物质,且A和D的式量相等,请用离子方程式表示F的水溶液呈酸性的原因
(3)若A中一种元素原子的最外层电子数为内层电子总数的
| 1 | 5 |
已知:A、B、C、D、E、F为原子序数依次增大的六种短周期元素.常温下,六种元素的常见单质中三种为气体,三种为固体.A与E,D与F分别同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D的最外层电子数之和与E的核外电子总数相等.试回答下列问题:
(1)写出下列元素的元素符号:C
(2)分子式为A2B2D4的化合物与含等物质的量KOH的溶液反应后所得溶液呈酸性,其原因是
(3)由A、C、D、F和Fe五种元素可组成类似明矾的化合物Z(化学式量为392),1mol Z中含有6mol结晶水.对化合物Z进行如下实验:
a.取Z的溶液,加入过量NaOH浓溶液并加热,产生白色沉淀和无色剌激性气味气体.白色沉淀迅速变灰绿色,最终变为红褐色;
b.另取Z的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.
①Z的化学式为
②已知100mL 1mol?L-1 Z溶液能与20mL 1mol?L-1KMnO4溶液(硫酸酸化)恰好反应,写出该反应的离子方程式:
查看习题详情和答案>>
(1)写出下列元素的元素符号:C
N
N
,FS
S
.(2)分子式为A2B2D4的化合物与含等物质的量KOH的溶液反应后所得溶液呈酸性,其原因是
HC2O4-的电离程度大于水解程度,使溶液中c(H+)>c(OH-)
HC2O4-的电离程度大于水解程度,使溶液中c(H+)>c(OH-)
(用文字表述).(3)由A、C、D、F和Fe五种元素可组成类似明矾的化合物Z(化学式量为392),1mol Z中含有6mol结晶水.对化合物Z进行如下实验:
a.取Z的溶液,加入过量NaOH浓溶液并加热,产生白色沉淀和无色剌激性气味气体.白色沉淀迅速变灰绿色,最终变为红褐色;
b.另取Z的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.
①Z的化学式为
(NH4)2Fe(SO4)2?6H2O
(NH4)2Fe(SO4)2?6H2O
②已知100mL 1mol?L-1 Z溶液能与20mL 1mol?L-1KMnO4溶液(硫酸酸化)恰好反应,写出该反应的离子方程式:
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
. (2012?西安一模)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
(2012?西安一模)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.(1)写出A元素的基态原子价电子排布式
2s22p4
2s22p4
;F离子电子排布式1s22s22p63s23p6
1s22s22p63s23p6
.(2)写出X的化学式
Na3AlF6
Na3AlF6
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:
氯化铝为分子晶体,氧化铝为原子晶体,用氧化铝冶炼铝消耗能量大
氯化铝为分子晶体,氧化铝为原子晶体,用氧化铝冶炼铝消耗能量大
.(4)CE、FA的晶格能分别为786KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是:
晶格能与离子的电荷呈正比,电荷越多,晶格能越大,钙离子、氧离子电荷大于钠离子、氯离子电荷
晶格能与离子的电荷呈正比,电荷越多,晶格能越大,钙离子、氧离子电荷大于钠离子、氯离子电荷
.(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为
CaF2
CaF2
;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是| 4×78g/mol |
| ag/cm3.6.02×1023/mol |
| 4×78g/mol |
| ag/cm3.6.02×1023/mol |
A、B、C、D、E、F为原子序数依次增大的同一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E.G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:
(1)写出E元素在元素周期表中的位置为 .
(2)D的原子结构示意图为 .
(3)用电子式表示出B、F形成化合物的过程: .
(4)以上元素中原子半径最大的是 金属性最强的元素是 (均用元素名称回答).
(5)实验室制备G的氢化物的化学方程式: .
(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1-2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是 .
②相应的化学方程式: .
查看习题详情和答案>>
(1)写出E元素在元素周期表中的位置为
(2)D的原子结构示意图为
(3)用电子式表示出B、F形成化合物的过程:
(4)以上元素中原子半径最大的是
(5)实验室制备G的氢化物的化学方程式:
(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1-2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是
②相应的化学方程式:
A、B、C、D、E、F为短周期元素,A~F原子序数依次增大,质子数之和为56;B、C同周期;A与D、C与F同主族;A、C能形成两种液态化合物A2C和A2C2;E是地壳中含量最多的金属元素.试回答:
(1)F元素在周期表中的位置是 ;B单质的结构式为 .
(2)C、D元素形成的淡黄色粉末状物质D2C2,其含有的化学键类型为 .
(3)A、C两元素原子可形成一种10电子粒子X-.Y与X-具有相同的原子种类及数目,但Y不带电,是决定醇类物质化学性质的官能团,请写出Y的电子式: ,Y作为醇类物质官能团的名称是 .
(4)将F的低价氧化物通入其氢化物的水溶液中产生淡黄色沉淀,写出该反应的化学方程式为 .
(5)将D的单质投入A2C中,反应后得到一种无色溶液.E的单质能与该无色溶液反应,写出该反应的离子方程式 .
查看习题详情和答案>>
(1)F元素在周期表中的位置是
(2)C、D元素形成的淡黄色粉末状物质D2C2,其含有的化学键类型为
(3)A、C两元素原子可形成一种10电子粒子X-.Y与X-具有相同的原子种类及数目,但Y不带电,是决定醇类物质化学性质的官能团,请写出Y的电子式:
(4)将F的低价氧化物通入其氢化物的水溶液中产生淡黄色沉淀,写出该反应的化学方程式为
(5)将D的单质投入A2C中,反应后得到一种无色溶液.E的单质能与该无色溶液反应,写出该反应的离子方程式