摘要:4.(1)淀粉 溶液由蓝色变无色.且半分钟后颜色不再改变 (2)C (3)分液漏斗.分液时上层液体应从上口出.下层液体应从下口出(或分液漏斗末端应紧靠烧杯内壁或打开上口活塞.使分液漏斗内外压强相等便于液体流下等.其他合理答案也给分), (4)0.085mol/L (5)961
网址:http://m.1010jiajiao.com/timu3_id_66600[举报]
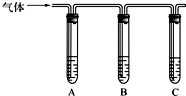 (2013?资阳二模)某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O.某学习小组拟探究该消毒液的变质情况.
(2013?资阳二模)某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O.某学习小组拟探究该消毒液的变质情况.(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过下列装置检验气体的成分可以判断消毒液是否变质.
学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙:
全部变质
全部变质
.为了验证可能为甲,请完成下列实验方案.限选试剂:
①98%的浓硫酸 ②1%的品红溶液 ③1.0mol?L-1 的KI-淀粉溶液 ④1.0mol?L-1的NaOH溶液 ⑤澄清石灰水 ⑥饱和NaCl溶液
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量 ③ ③ (填序号);试管B中加1%品红溶液; 试管C中加 ⑤ ⑤ (填序号). |
若 A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊 A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊 ,则甲成立. |
①量取25.00mL消毒液放入锥形瓶中,加入过量的a mol?L-1 Na2SO3溶液v1 mL;
②在使用滴定管之前首先进行的操作是
检查滴定管是否漏液(或检漏
检查滴定管是否漏液(或检漏
;将b mol?L-1的酸性KMnO4溶液装入酸式滴定管
酸式滴定管
中;滴定,KMnO4和剩余的Na2SO3发生反应.当溶液由无色变成浅红色,且保持半分钟内红色不褪时,停止滴定,记录数据.③重复滴定操作2次,平均消耗酸性KMnO4溶液v2 mL.则消毒液中NaClO的浓度为
av1-
| ||
| 25 |
av1-
| ||
| 25 |
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.现利用图所示装置进行实验.
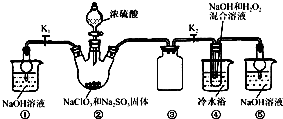
(1)装置③的作用是
(2)装置②中产生ClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③
实验Ⅱ:测定某亚氯酸钠样品的纯度.
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:Cl
+4I-+4H+═2H2O+2I2+Cl-);将所得混合液配成250mL待测溶液.
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol?L-1 Na2S2O3标准液滴定,至滴定终点.重复2次,测得平均值为V mL(已知:I2+2S2
═2I-+S4
.
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为
%
%(用含m、c、V的代数式表示).
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为
查看习题详情和答案>>
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.现利用图所示装置进行实验.

(1)装置③的作用是
防止倒吸
防止倒吸
.(2)装置②中产生ClO2的化学方程式为
2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O
2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O
;装置④中制备NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2
.(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③
用38℃~60℃热水洗涤
用38℃~60℃热水洗涤
;④低于60℃干燥,得到成品.实验Ⅱ:测定某亚氯酸钠样品的纯度.
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:Cl
| O | - 2 |
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol?L-1 Na2S2O3标准液滴定,至滴定终点.重复2次,测得平均值为V mL(已知:I2+2S2
| O | - 2 |
| O | 2- 6 |
(4)达到滴定终点时的现象为
滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点
滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点
.(5)该样品中NaClO2的质量分数为
| 90.5cV |
| 4m |
| 90.5cV |
| 4m |
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为
4I-+O2+4H+=2I2+2H2O
4I-+O2+4H+=2I2+2H2O
.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.ClO2是一种黄绿色的气体,易溶于水.实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
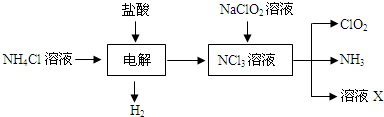
(1)写出电解时发生反应的化学方程式:
(2)除去ClO2中的NH3可选用的试剂是
A.碳酸钠溶液 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液.
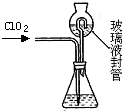
①ClO2通入锥形瓶与酸性碘化钾溶液反应(还原产物为Cl-),反应的离子方程式为:
②装置中玻璃液封管的作用是
③滴定至终点的现象是
④测得ClO2的质量m(ClO2)
(4)设计实验来确定溶液X的成份,请补充完成实验步骤和现象.
查看习题详情和答案>>

(1)写出电解时发生反应的化学方程式:
NH4Cl+2HCl═3H2↑+NCl3
NH4Cl+2HCl═3H2↑+NCl3
.(2)除去ClO2中的NH3可选用的试剂是
C
C
.(填序号)A.碳酸钠溶液 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液.

①ClO2通入锥形瓶与酸性碘化钾溶液反应(还原产物为Cl-),反应的离子方程式为:
2ClO2+10I-+8H+=2Cl-+5I2+4H2O
2ClO2+10I-+8H+=2Cl-+5I2+4H2O
.②装置中玻璃液封管的作用是
用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等
用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等
.③滴定至终点的现象是
溶液由蓝色恰好变为无色,且半分钟内不褪色
溶液由蓝色恰好变为无色,且半分钟内不褪色
.④测得ClO2的质量m(ClO2)
1.35cv×10-2g
1.35cv×10-2g
.(用含c、V的代数式表示)(4)设计实验来确定溶液X的成份,请补充完成实验步骤和现象.
| 实验步骤 | 实验现象 | 实验结论 |
| ① 取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 |
火焰呈黄色 火焰呈黄色 |
溶液X中含有钠离子 |
| ② 取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液) 取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液) |
产生白色沉淀 产生白色沉淀 |
溶液X中含有氯离子 |
CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物.通过下述实验确定该晶体的组成.
步骤a:称取0.6720g样品,放入锥形瓶,加入适量2mol?L-1稀硫酸,微热使样品溶解.再加入30ml水加热,用0.2000mol?L-1 KMnO4溶液滴定至终点,消耗8.00ml.
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色.冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI.用0.2500mol?L-1 Na2S2O3标准溶液滴定至终点,消耗8.00ml.
已知涉及的部分离子方程式为:
步骤a:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6mol?L-1,应保持溶液中c(I-)≥
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+.
该反应的离子方程式为
若无该操作,则测定的Cu2+的含量将会
(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为
(4)通过计算确定样品晶体的组成.
查看习题详情和答案>>
步骤a:称取0.6720g样品,放入锥形瓶,加入适量2mol?L-1稀硫酸,微热使样品溶解.再加入30ml水加热,用0.2000mol?L-1 KMnO4溶液滴定至终点,消耗8.00ml.
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色.冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI.用0.2500mol?L-1 Na2S2O3标准溶液滴定至终点,消耗8.00ml.
已知涉及的部分离子方程式为:
步骤a:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6mol?L-1,应保持溶液中c(I-)≥
1.27×10-6
1.27×10-6
mol?L-1.(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+.
该反应的离子方程式为
4MnO4-+12H+
4Mn2++5O2↑+6H2O
| ||
4MnO4-+12H+
4Mn2++5O2↑+6H2O
.
| ||
若无该操作,则测定的Cu2+的含量将会
偏高
偏高
(填“偏高”、“偏低”或“不变”).(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为
溶液由蓝色变为无色,且半分钟内不变色
溶液由蓝色变为无色,且半分钟内不变色
.(4)通过计算确定样品晶体的组成.
北京市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
写出Na2SO3稀溶液与I2反应的离子方程式是
(3)已知:I2+2S2O32-=2I-+S4O62-.
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L 的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全所依据的现象
②b中反应所产生的I2的物质的量是
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
查看习题详情和答案>>
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计算) | 20~50mg/kg |
| 分装日期 | \ |
| 分装企业 | \ |
1
1
KIO3+5
5
KI+5
5
H2SO4═3
3
K2SO4+3
3
I2+3
3
H2O(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
写出Na2SO3稀溶液与I2反应的离子方程式是
I2+SO32-+H2O=2I-+SO42-+2H+
I2+SO32-+H2O=2I-+SO42-+2H+
.(3)已知:I2+2S2O32-=2I-+S4O62-.
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L 的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全所依据的现象
滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色
滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色
.②b中反应所产生的I2的物质的量是
1.0×10-5
1.0×10-5
mol.③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
423/w
423/w
mg/kg.