网址:http://m.1010jiajiao.com/timu3_id_66597[举报]
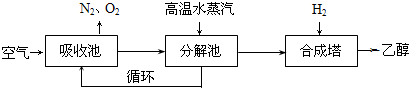
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇. 回答下列问题:
(1)写出吸收池中反应的离子方程式
(2)从分解池中循环使用的物质是
(3)工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g) 请写出该反应的化学平衡常数表达式K=
| c(CH3CH2OH)?c(H2O) |
| c2(CO)?c4(H2) |
| c(CH3CH2OH)?c(H2O) |
| c2(CO)?c4(H2) |
(4)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数.则由CO制取CH3CH2OH的优点是
由CO2制取CH3CH2OH的优点是
(5)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如下表:
| 温度(K) CO2转化率(%) n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度升高,该反应的平衡常数K值
②提高氢碳比(
| n(H2) |
| n(CO2) |
由碳的氧化物直接合成乙醇燃料已进入大规模生产。
Ⅰ.目前工业上可以用CO2来生产CH3CH2OH。反应为:2CO2(g)+6H2(g) CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:

根据表中数据分析:
(1)该反应的正反应是_________(选填“吸热”或“放热”)反应。
(2)提高氢碳比n(H2)/n(CO2),对生成乙醇 _______(选填“不利”、“有利”或“无影响”)。
(3)在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3CH2OH)增大的是_______(填字母,下同)。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1molCO2和3molH2
Ⅱ.工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
(4)请写出该反应的化学平衡常数表达式K= ___________。
(5)一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是___________。
A.c(CO)=c(H2) B.v正(CO)=v逆(H2O)
C.容器中的压强不变 D.消耗2molCO的同时生成1molCH3CH2OH
(6)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是______________________,由CO2制取CH3CH2OH的优点是____________。(写出一点即可)
查看习题详情和答案>>
由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙醇的技术流程: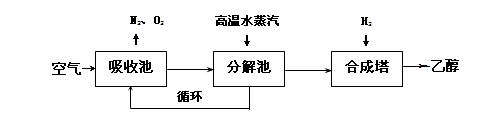
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇。回答下列问题:
(1)写出吸收池中反应的离子方程式 。
(2)从分解池中循环使用的物质是 。
(3)工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g)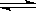 CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
写出该反应的化学平衡常数表达式 K= 。
(4)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是使原料有较大的转化率 ,由CO2制取CH3CH2OH的优点是 。(写出一点即可)
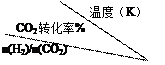 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
根据表中数据分析:
①温度升高,该反应的平衡常数K值 (选填“增大”、“减小”或“不变”);
②提高氢碳n(H2)/n(CO2)比,对生成乙醇 (选填“不利”、“有利”或“无影响”)。 查看习题详情和答案>>
由碳的氧化物直接合成乙醇燃料已进入大规模生产。
Ⅰ.目前工业上可以用CO2来生产CH3CH2OH。反应为:2CO2(g)+6H2(g)CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
根据表中数据分析:
(1)该反应的正反应是_________(选填“吸热”或“放热”)反应。
(2)提高氢碳比n(H2)/n(CO2),对生成乙醇 _______(选填“不利”、“有利”或“无影响”)。
(3)在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3CH2OH)增大的是_______(填字母,下同)。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1molCO2和3molH2
Ⅱ.工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)
(4)请写出该反应的化学平衡常数表达式K= ___________。
(5)一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是___________。
A.c(CO)=c(H2) B.v正(CO)=v逆(H2O)
C.容器中的压强不变 D.消耗2molCO的同时生成1molCH3CH2OH
(6)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是______________________,由CO2制取CH3CH2OH的优点是____________。(写出一点即可)
查看习题详情和答案>>
由碳的氧化物直接合成乙醇燃料已进入大规模生产。
Ⅰ.目前工业上可以用CO2来生产CH3CH2OH。反应为:2CO2(g)+6H2(g) CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
根据表中数据分析:
(1)该反应的正反应是_________(选填“吸热”或“放热”)反应。
(2)提高氢碳比n(H2)/n(CO2),对生成乙醇 _______(选填“不利”、“有利”或“无影响”)。
(3)在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3CH2OH)增大的是_______(填字母,下同)。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1molCO2和3molH2
Ⅱ.工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
(4)请写出该反应的化学平衡常数表达式K= ___________。
(5)一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是___________。
A.c(CO)=c(H2) B.v正(CO)=v逆(H2O)
C.容器中的压强不变 D.消耗2molCO的同时生成1molCH3CH2OH
(6)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是______________________,由CO2制取CH3CH2OH的优点是____________。(写出一点即可)