网址:http://m.1010jiajiao.com/timu3_id_66450[举报]
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺流程如下: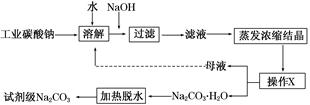
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示: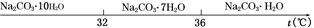
Ⅱ.有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液后过滤得到的滤渣中主要含有________(填写化学式)。25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8 时,c(Mg2+)∶c(Fe3+)=________。
(2)操作X为________,其温度应控制在_____________________________________
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行________,并说明理由______________________________
________________________________________________________________________。 查看习题详情和答案>>
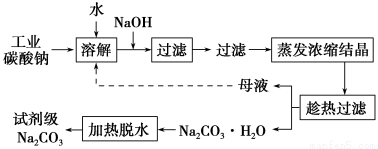
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:

Ⅱ.有关物质的溶度积如下:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生反应的离子方程式为:_____________________________________。
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=________。
(2)“趁热过滤”时的温度应控制在________。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行________,并说明理由________________________________________。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH=+473.63 kJ·mol-1
写出NaCO3·H2O脱水反应的热化学方程式________________________________________。
查看习题详情和答案>>
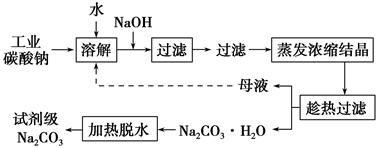
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
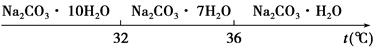
Ⅱ.有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生反应的离子方程式为:_____________________________________。
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=________。
(2)“趁热过滤”时的温度应控制在________。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行________,并说明理由________________________________________。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH=+473.63 kJ·mol-1
写出NaCO3·H2O脱水反应的热化学方程式________________________________________。
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
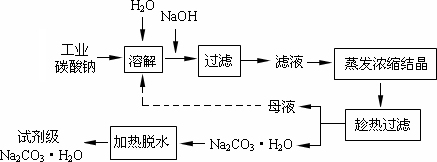
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
Ⅱ、25℃时有关物质的溶度积如下(物质溶解时溶液中其电离的离子浓度的乘积):

回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为________.
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=________.
(2)“趁热过滤”时的温度应控制在________.
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用.请你分析实际工业生产中是否可行________,并说明理由________.
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ·mol-1 Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH=+473.63 kJ·mol-1写出Na2CO3·H2O脱水反应的热化学方程式________.
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示:
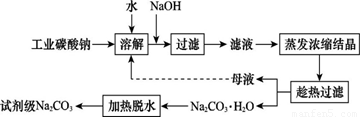
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
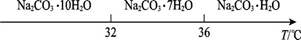
Ⅱ.有关物质的溶度积如下
|
物质 |
CaCO3 |
MgCO3 |
Ca(0H)2 |
Mg(OH)2 |
Fe(OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“母液”中除了含有Na+、CO32—外,还含有 等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行: (填“可行”或“不可行”),并说明理由: 。
(4)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g)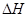 =+532.36 kJ·mol-1
=+532.36 kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g) 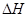 =+473.63
kJ·mol-1
=+473.63
kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式: 。
查看习题详情和答案>>