网址:http://m.1010jiajiao.com/timu3_id_66194[举报]
(14分)A、B、C、D、E五种短周期元素,其中A、B、C处于相邻位置,且三种元素原子序数依次增大,原子序数之和是41。D的原子序数介于A、B之间,D单质在空气中燃烧生成淡黄色固体。E的一种核素中无中子。
(1)元素符号:A 、B 、C 、D 、E 。
(2)写出制取A2的化学方程式: (反应物仅能利用题设的五种元素中的某几种)
(3)写出实验室制取C2的离子方程式:
(4)检验某溶液中含有BA42-的方法是:
。
查看习题详情和答案>>(1)A在元素周期表中的位置为
(2)A的氢化物的结构式为
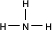
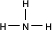
(3)C的氢化物的电子式为
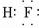
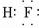


(4)E的氧化物与D的最高价氧化物对应的水化物反应的离子方程式为
| A | C | |
| B |
有A、B、C、D、E五种短周期元素,其中A元素和B元素的原子都有一个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4;E元素的基态原子核外有六种运动状态的电子。请回答下列问题:
(1)A元素的简单离子基态时的电子排布式为 R是由C元素与氢元素两种元素形成的18电子分子,R的电子式为
(2)CB3分子的空间构型是 ,其中心原子的杂化类型是
(3)由D、E、C三元素可形成共价化合物(DEC)2(分子中各原子均达8电子稳定结构),每个分子中含 个δ键。
(4)E的一种低价氧化物与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池。则该燃料电池的负极反应为 正极反应为
(5)1.2gE的单质在标准状况下的1.68L氧气中燃烧,至反应物耗尽,放出X KJ热量。则1molE与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为Y KJ/mol)
查看习题详情和答案>>
有A、B、C、D、E五种短周期元素,其中A元素和B元素的原子都有一个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4;E元素的基态原子核外有六种运动状态的电子。请回答下列问题:
(1)A元素的简单离子基态时的电子排布式为 R是由C元素与氢元素两种元素形成的18电子分子,R的电子式为
(2)CB3分子的空间构型是 ,其中心原子的杂化类型是
(3)由D、E、C三元素可形成共价化合物(DEC)2(分子中各原子均达8电子稳定结构),每个分子中含 个δ键。
(4)E的一种低价氧化物与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池。则该燃料电池的负极反应为 正极反应为
(5)1.2gE的单质在标准状况下的1.68L氧气中燃烧,至反应物耗尽,放出X KJ热量。则1molE与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为Y KJ/mol)
(1)A元素的简单离子基态时的电子排布式为______R是由C元素与氢元素两种元素形成的18电子分子,R的电子式为______
(2)CB3分子的空间构型是______,其中心原子的杂化类型是______
(3)由D、E、C三元素可形成共价化合物(DEC)2(分子中各原子均达8电子稳定结构),每个分子中含______个δ键.
(4)E的一种低价氧化物与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池.则该燃料电池的负极反应为______ 正极反应为______
(5)1.2gE的单质在标准状况下的1.68L氧气中燃烧,至反应物耗尽,放出X KJ热量.则1molE与O2反应生成E的低价氧化物时的热化学方程式为______ (已知:E的燃烧热为Y KJ/mol)