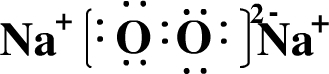题目内容
有A、B、C、D、E五种短周期元素,其中A元素和B元素的原子都有一个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4;E元素的基态原子核外有六种运动状态的电子。请回答下列问题:
(1)A元素的简单离子基态时的电子排布式为 R是由C元素与氢元素两种元素形成的18电子分子,R的电子式为
(2)CB3分子的空间构型是 ,其中心原子的杂化类型是
(3)由D、E、C三元素可形成共价化合物(DEC)2(分子中各原子均达8电子稳定结构),每个分子中含 个δ键。
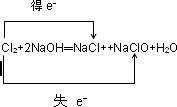
(4)E的一种低价氧化物与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池。则该燃料电池的负极反应为 正极反应为
(5)1.2gE的单质在标准状况下的1.68L氧气中燃烧,至反应物耗尽,放出X KJ热量。则1molE与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为Y KJ/mol)
(16分)(每空2分)(1)1s22s22p6
 (2)三角锥型
sp3
(2)三角锥型
sp3
(3)5(4)CO+CO32--2e-=2CO2 O2+2CO2+4e-=2CO32-
(5)C(s)+ O2(g)=CO(g)△H=-(20X-Y)kJ/mol
O2(g)=CO(g)△H=-(20X-Y)kJ/mol
【解析】
试题分析:有A、B、C、D、E五种短周期元素,B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;B-离子为Cl-离子,A+比B-少一个电子层,A+为Na+离子,A为Na元素;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为ns2np3,是第ⅤA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第ⅥA族元素,故D为S元素,E元素的基态原子核外有六种运动状态的电子,即核外电子数为6,故E为C元素.(1)A元素的简单离子为Na+,基态时的电子排布式为1s22s22p6,R是由N元素与氢元素两种元素形成的18电子分子,R为N2H4,电子式为 ;(2)CB3分子为NCl3,分子中N原子成3个N-Cl键,含有1对孤对电子,杂化轨道数目为4,为三角锥型,N原子采取sp3杂化;(3)D、E、C三元素形成共价化合物为(SCN)2,分子中各原子均达8电子稳定结构,结构简式为N≡C-S-S-C≡N,故每个分子中含5个δ键;(4)E的一种低价氧化物CO与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池,原电池负极发生氧化反应,CO在负极通入,CO被氧化,在熔融碳酸钾中生成CO2,电极反应式为:CO+CO32--2e-=2CO2,正极发生还原反应,氧气再正极通入,二氧化碳参与的反应生成CO32-,电极反应式为:O2+2CO2+4e-=2CO32-,(5)1.2g碳的物质的量为0.1mol,标准状况下的1.68L氧气的物质的量为0.075mol,所以n(C):n(O)=0.1mol:0.075mol×2=1:1.5,故燃烧生成物为CO、CO2,令CO、CO2的物质的量分别为xmol、ymol,根据C原子守恒有x+y=0.1,根据O原子守恒有x+2y=0.075×2,联立方程,解得x=0.05,y=0.05,碳的燃烧热为Y KJ/mol,故生成0.05molCO2放出的热量为0.05mol×Y kJ/mol=0.05YkJ,故生成0.05molCO放出的热量为X kJ-0.05YkJ=(X-0.05Y)kJ,故1mol碳燃烧生成CO放出的热量为(X-0.05Y)kJ×
;(2)CB3分子为NCl3,分子中N原子成3个N-Cl键,含有1对孤对电子,杂化轨道数目为4,为三角锥型,N原子采取sp3杂化;(3)D、E、C三元素形成共价化合物为(SCN)2,分子中各原子均达8电子稳定结构,结构简式为N≡C-S-S-C≡N,故每个分子中含5个δ键;(4)E的一种低价氧化物CO与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池,原电池负极发生氧化反应,CO在负极通入,CO被氧化,在熔融碳酸钾中生成CO2,电极反应式为:CO+CO32--2e-=2CO2,正极发生还原反应,氧气再正极通入,二氧化碳参与的反应生成CO32-,电极反应式为:O2+2CO2+4e-=2CO32-,(5)1.2g碳的物质的量为0.1mol,标准状况下的1.68L氧气的物质的量为0.075mol,所以n(C):n(O)=0.1mol:0.075mol×2=1:1.5,故燃烧生成物为CO、CO2,令CO、CO2的物质的量分别为xmol、ymol,根据C原子守恒有x+y=0.1,根据O原子守恒有x+2y=0.075×2,联立方程,解得x=0.05,y=0.05,碳的燃烧热为Y KJ/mol,故生成0.05molCO2放出的热量为0.05mol×Y kJ/mol=0.05YkJ,故生成0.05molCO放出的热量为X kJ-0.05YkJ=(X-0.05Y)kJ,故1mol碳燃烧生成CO放出的热量为(X-0.05Y)kJ× =(20X-Y)kJ,故1mol碳与O2反应生成CO时的热化学方程式为:C(s)+
=(20X-Y)kJ,故1mol碳与O2反应生成CO时的热化学方程式为:C(s)+ O2(g)=CO(g)△H=-(20X-Y)kJ/mol
O2(g)=CO(g)△H=-(20X-Y)kJ/mol
考点: 原子结构与元素周期率的关系;原子核外电子排布;共价键的形成及共价键的主要类型;判断简单分子或离子的构型;原子轨道杂化方式及杂化类型判断.

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案