摘要:2. ⑴,三,ⅢA ⑵Al3++3AlO2-+6H2O = 4Al(OH)3 Fe2O3+2Al 2Fe + Al2O3 (Fe2O3若写成FeO或Fe3O4并配平也可以) ⑶分子 ⑷ 1∶104
网址:http://m.1010jiajiao.com/timu3_id_66130[举报]
(2011?临沂模拟)图中B为日常生活中常见的金属,E是一种新型的清洁能源,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是生理盐水主要成分(图中部分反应物或生成物没有列出).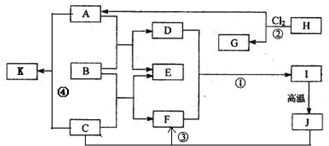
请按要求回答:
(1)写出B在周期表的位置第
 .
.
(2)反应①的离子方程式为
(3)反应②进行的条件是
(4)反应③的化学方程式为
查看习题详情和答案>>

请按要求回答:
(1)写出B在周期表的位置第
三
三
周期ⅢA
ⅢA
族,G的电子式

(2)反应①的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.(3)反应②进行的条件是
光照
光照
,过量Cl2
过量Cl2
.(4)反应③的化学方程式为
Al2O3+2NaOH═2NaAlO2+H2O
Al2O3+2NaOH═2NaAlO2+H2O
. 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同.
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同.回答下列问题:
(1)B的元素名称为
磷
磷
,D在周期表中的位置第三周期ⅦA族
第三周期ⅦA族
.(2)A,C,D对应的离子半径由大到小顺序为
S2->Cl->O2-
S2->Cl->O2-
,(用化学符号表示)(3)D的单质与水反应的离子方程式为
Cl2+H2O=H++Cl-+HClO
Cl2+H2O=H++Cl-+HClO
.(4)向D与E形成的化合物的水溶液中滴入过量烧碱溶液,用离子方程式表述
Al3++4OH--=AlO2-+2H2O
Al3++4OH--=AlO2-+2H2O
.(2011?顺义区二模)X、Y、Z是中学化学常见的三种元素,其中,X、Z位于短周期.常温下,X单质为黄绿色气体;向含Y离子的溶液中滴加氢氧化钠溶液,生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;Z的最外层电子数与核外电子总数之比为3:13.请回答下列问题:
(1)Z在元素周期表中的位置是
 .
.
(2)Z单质与Y的氧化物在高温条件下反应是冶炼Y单质的一种方法,该反应化学方程式是
(3)含上述元素的某些物质常用于处理工业废水,部分流程如图1:
①处理含铬废水时,在反应池中Cr2O72-变为Cr3+,当反应转移1mol 电子时,有
②含Z化合物可以使水中悬浮颗粒发生凝聚,原因是
③处理含氰废水时,CN-最终转化为两种无毒的气体,该反应的离子方程式是
(4)利用图2方法电解可得到一种新型净水剂K2YO4,阳极的电极反应式为
查看习题详情和答案>>
(1)Z在元素周期表中的位置是
三周期ⅢA族
三周期ⅢA族
,X单质分子的电子式是

(2)Z单质与Y的氧化物在高温条件下反应是冶炼Y单质的一种方法,该反应化学方程式是
Fe2O3+2Al
Al2O3+3Fe或3Fe3O4+8Al
4Al2O3+9Fe或3FeO+2Al
Al2O3+3Fe
| ||
| ||
| ||
Fe2O3+2Al
Al2O3+3Fe或3Fe3O4+8Al
4Al2O3+9Fe或3FeO+2Al
Al2O3+3Fe
.
| ||
| ||
| ||
(3)含上述元素的某些物质常用于处理工业废水,部分流程如图1:

①处理含铬废水时,在反应池中Cr2O72-变为Cr3+,当反应转移1mol 电子时,有
0.17
0.17
mol Cr2O72- 转化(计算结果保留两位小数).②含Z化合物可以使水中悬浮颗粒发生凝聚,原因是
Al3++3H2O Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来
Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来
 Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来
Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来Al3++3H2O Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来
Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来
(用文字和化学用语表示). Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来
Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来③处理含氰废水时,CN-最终转化为两种无毒的气体,该反应的离子方程式是
2CN-+5Cl2+8OH-=2CO2+N2+H2O+10Cl-
2CN-+5Cl2+8OH-=2CO2+N2+H2O+10Cl-
.(4)利用图2方法电解可得到一种新型净水剂K2YO4,阳极的电极反应式为
Fe-6e-+8OH-=FeO42-+4H2O
Fe-6e-+8OH-=FeO42-+4H2O
.(2013?武汉模拟)工业上通常以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料制备无水氯化铝:
2Al2O3+6Cl2
4AlCl3+3O2↑.回答以下问题:
(1)画出Al的原子结构示意图
 ;Cl元素在元素周期表第
;Cl元素在元素周期表第
(2)为促进反应的进行,实际生产中需加入焦炭,其原因是
(3)加入焦炭后的化学反应可表示为Al2O3+C+Cl2
AlCl3+X↑,设计实验确定气体X的成分:
(4)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物.该反应的化学方程式为
(5)以铝土矿为原料可以通过以下途径提纯氧化铝:
①写出滤液甲中溶质的化学式
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式
查看习题详情和答案>>
2Al2O3+6Cl2
| ||
(1)画出Al的原子结构示意图


三
三
周期ⅤⅡA
ⅤⅡA
族.(2)为促进反应的进行,实际生产中需加入焦炭,其原因是
碳与O2反应,有利于反应正向进行
碳与O2反应,有利于反应正向进行
.(3)加入焦炭后的化学反应可表示为Al2O3+C+Cl2
| △ |
气体X可能为CO、CO2或两者的混合物,将生成气体依次通过澄清石灰水、灼热的CuO粉末,如溶液变浑浊,则X中存在CO2,如黑色CuO粉末变成红色粉末,则X中存在CO
气体X可能为CO、CO2或两者的混合物,将生成气体依次通过澄清石灰水、灼热的CuO粉末,如溶液变浑浊,则X中存在CO2,如黑色CuO粉末变成红色粉末,则X中存在CO
.(4)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物.该反应的化学方程式为
Al+3FeCl3=AlCl3+3FeCl2
Al+3FeCl3=AlCl3+3FeCl2
.(5)以铝土矿为原料可以通过以下途径提纯氧化铝:

①写出滤液甲中溶质的化学式
NaAlO2、Na2SiO3、NaOH
NaAlO2、Na2SiO3、NaOH
.②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
.(1)上表中的实线是元素周期表部分边界,请在表中用实线画出金属元素的边界(实线内的元素全是金属元素)
(2)元素甲是第三周期ⅦA族元素,化合物A是由甲元素等非金属元素组成的离子化合物写出其化学式
(3)元素乙是第三周期原子半径最小的金属元素,丙是短周期元素中原子半径最大的元素,用电子式表示丙在空气中加热反应生成B的形成过程
 .B中含有的化学键是
.B中含有的化学键是
(4)化合物C是由甲元素和乙元素形成的化合物,将化合物A与化合物C等物质的量溶于水中,向其中滴加过量的2mol?L-1氢氧化钠溶液,直至形成透明溶液.请根据实验现象出现的先后顺序,依次写出离子方程式:
(5)实验中丙元素的鉴别方法
查看习题详情和答案>>

(2)元素甲是第三周期ⅦA族元素,化合物A是由甲元素等非金属元素组成的离子化合物写出其化学式
NH4Cl
NH4Cl
,(3)元素乙是第三周期原子半径最小的金属元素,丙是短周期元素中原子半径最大的元素,用电子式表示丙在空气中加热反应生成B的形成过程


离子键和非极性键(或离子键和共价键)
离子键和非极性键(或离子键和共价键)
(4)化合物C是由甲元素和乙元素形成的化合物,将化合物A与化合物C等物质的量溶于水中,向其中滴加过量的2mol?L-1氢氧化钠溶液,直至形成透明溶液.请根据实验现象出现的先后顺序,依次写出离子方程式:
Al3++3OH-=Al(OH)3
Al3++3OH-=Al(OH)3
NH4++OH-=NH3+H2O (NH3?H2O)
NH4++OH-=NH3+H2O (NH3?H2O)
Al(OH)3+OH-=AlO2-+H2O
Al(OH)3+OH-=AlO2-+H2O
.(5)实验中丙元素的鉴别方法
焰色反应
焰色反应
(不写过程)与现象火焰呈现黄色
火焰呈现黄色
.