摘要:11.①铁屑 ②防止NH4HCO3 分解(或减少Fe2+的水解 ) (2)①氯化铵 (或NH4Cl) , 化肥或电解液或焊药 ②滴加过量Ba(NO3)2溶液.过滤后向滤液滴加AgNO3溶液 (3)4FeCO3 + O2 2Fe2O3 + 4CO2 坩埚.坩埚钳 (4)2SO42--2e-=S2O82-
网址:http://m.1010jiajiao.com/timu3_id_66124[举报]
(2013?江苏三模)某研究小组利用工业生产钛白粉产生的废液(含有大量的Fe2+、H+、S和少量的Fe3+、TiO2+)生产乳酸亚铁,其工艺流程如图所示:
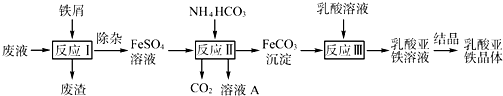
(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+?2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=
.
(2)反应Ⅱ需控制反应温度低于35℃,其目的是
(3)已知:FeCO3(s)?Fe2+(aq)+C(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因:
(4)结晶过程必须控制在一定的真空度条件下进行,原因是:
查看习题详情和答案>>

(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+?2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
(2)反应Ⅱ需控制反应温度低于35℃,其目的是
防止NH4HCO3分解(或减少Fe2+的水解)
防止NH4HCO3分解(或减少Fe2+的水解)
,该反应的化学方程式是FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4
FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4
.检验溶液A中是否含Fe2+的实验操作方法是取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+
取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+
.(3)已知:FeCO3(s)?Fe2+(aq)+C(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因:
C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁
C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁
.(4)结晶过程必须控制在一定的真空度条件下进行,原因是:
有利于水的蒸发
有利于水的蒸发
、防止Fe2+被氧化
防止Fe2+被氧化
.(2009?江苏)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高.其主要流程如下:

(1)反应I前需在FeSO4溶液中加入
A.锌粉 B.铁屑 C.KI溶液 D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵).电解时均用惰性电极,阳极发生地电极反应可表示为
查看习题详情和答案>>

(1)反应I前需在FeSO4溶液中加入
B
B
(填字母),以除去溶液中的Fe3+.A.锌粉 B.铁屑 C.KI溶液 D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是
防止NH4HCO3分解(或减少Fe2+的水解)
防止NH4HCO3分解(或减少Fe2+的水解)
.(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
降低K2SO4的溶解度,有利于K2SO4析出
降低K2SO4的溶解度,有利于K2SO4析出
.(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵).电解时均用惰性电极,阳极发生地电极反应可表示为
2SO42--2e-═S2O82-
2SO42--2e-═S2O82-
.