摘要:8.海水是巨大的资源宝库.在海水淡化及综合利用方面.天津市位居全国前列.从海水中提取食盐和溴的过程如下: (1)请列举海水淡化的两种方法: . . (2)将NaCl溶液进行电解.在电解槽中可直接得到的产品有H2. . 或H2. . (3)步骤I中已获得Br2.步骤Ⅱ中又将Br2还原为Br-.其目的为 . (4)步骤Ⅱ用SO2水溶液吸收Br2.吸收率可达95%,有关反应的离子方程式为 .由此反应可知.除环境保护外.在工业生产中应解决的主要问题是 . (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法.查阅了有关资料:Br2的沸点为59℃.微溶于水.有毒性和强腐蚀性.他们参观生产过程后.绘制了如下装置简图: 请你参与分析讨论: ①图中仪器B的名称: . ②整套实验装置中仪器连接均不能用橡胶塞和橡胶管.其原因为 . ③实验装置气密性良好.要达到提纯溴的目的.操作中如何控制关键条件: . ④C中液体产物颜色为 .为除去该产物中仍残留的少量Cl2.可向其中加入NaBr溶液.充分反应后.再进行的分离操作是 .
网址:http://m.1010jiajiao.com/timu3_id_66119[举报]
海水是巨大的资源宝库,可以进行综合利用.从海水中提取食盐和溴的过程如下:
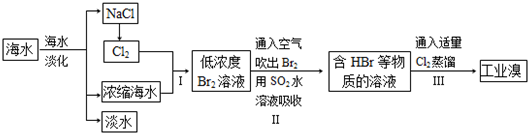
(1)请写出一种海水淡化的方法:
(2)步骤Ⅰ获得Br2的离子方程式为
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的.其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
查看习题详情和答案>>

(1)请写出一种海水淡化的方法:
蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法(任选一种);
蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法(任选一种);
.(2)步骤Ⅰ获得Br2的离子方程式为
Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
;(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的.其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是
Br2
Br2
(填化学式).若反应中生成2molHBr,则消耗1
1
molSO2,若完全吸收后的酸溶液体积为500mL,则溶液中氢离子浓度为8
8
mol/L.(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
Cl2>Br2>SO2
Cl2>Br2>SO2
.海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义.请回答下列问题: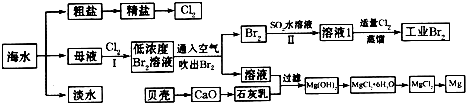
(1)请列举海水淡化的一种方法
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是
(3)步骤I已经获得Br2,步骤II又将Br2还原为Br-,其目的是
(4)写出步骤II反应的离子方程式
(5)Mg(OH)2沉淀中混有Ca(OH)2,可选用
(6)将MgCl2?6H2O直接加热能否得到MgCl2固体?
查看习题详情和答案>>

(1)请列举海水淡化的一种方法
蒸馏法(或电渗析法)
蒸馏法(或电渗析法)
.(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是
CCl4
CCl4
,所用主要仪器的名称是分液漏斗
分液漏斗
.(3)步骤I已经获得Br2,步骤II又将Br2还原为Br-,其目的是
浓缩、提纯溴元素(或富集溴元素)
浓缩、提纯溴元素(或富集溴元素)
.(4)写出步骤II反应的离子方程式
Br2+SO2+2H2O=4H++SO+2Br-
Br2+SO2+2H2O=4H++SO+2Br-
.(5)Mg(OH)2沉淀中混有Ca(OH)2,可选用
氯化镁或MgCl2
氯化镁或MgCl2
溶液进行洗涤除去.(6)将MgCl2?6H2O直接加热能否得到MgCl2固体?
否
否
.用化学方程式解释出原因MgCl2+2H2O
Mg(OH)2+2HCl↑,Mg(OH)2
MgO+H2O或MgCl2+H2O
MgO+2HCl↑
| ||
| ||
| ||
MgCl2+2H2O
Mg(OH)2+2HCl↑,Mg(OH)2
MgO+H2O或MgCl2+H2O
MgO+2HCl↑
.
| ||
| ||
| ||
海水中溶解了大量的气体物质和各种盐类.人类在陆地上发现的100多种元素,在海水中可以找到80多种.海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景.
回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但由于使用大量燃煤,因此能耗多、排污量大.为克服蒸馏法海水淡化的缺陷,使用离子交换树脂与水中的离子进行交换也是常用的水处理技术.聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式
(2)空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):
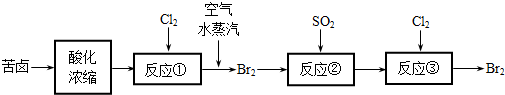
①反应②的离子方程式为
②从反应③后的溶液中分离出单质溴的方法是
(3)苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质.用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有
查看习题详情和答案>>
回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但由于使用大量燃煤,因此能耗多、排污量大.为克服蒸馏法海水淡化的缺陷,使用离子交换树脂与水中的离子进行交换也是常用的水处理技术.聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式
CH2=CHCOONa
CH2=CHCOONa
.(2)空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):

①反应②的离子方程式为
SO2+Br2+2H2O=4H++2Br-+SO42-
SO2+Br2+2H2O=4H++2Br-+SO42-
;②从反应③后的溶液中分离出单质溴的方法是
蒸馏
蒸馏
.(3)苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质.用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有
苦卤样品的体积、加入BaCl2溶液后生成的BaSO4的质量、加入NaOH溶液后生成的Mg(OH)2的质量
苦卤样品的体积、加入BaCl2溶液后生成的BaSO4的质量、加入NaOH溶液后生成的Mg(OH)2的质量
.海水是巨大的资源宝库,可以进行综合利用.从海水中提取食盐和溴的过程如下:
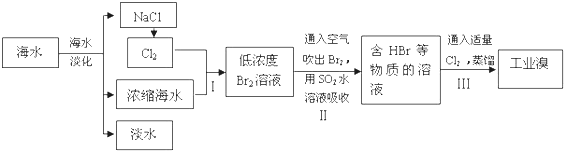
(1)请写出一种海水淡化的方法: .
(2)步骤Ⅰ获得Br2 的离子方程式为 ;
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的.其反应方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是 (填化学式).若反应中生成 2mol HBr,则消耗 mol SO2.
(4)根据上述反应判断 SO2、Cl2、Br2 三种物质氧化性由强到弱的顺序是 .
查看习题详情和答案>>

(1)请写出一种海水淡化的方法:
(2)步骤Ⅰ获得Br2 的离子方程式为
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的.其反应方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是
(4)根据上述反应判断 SO2、Cl2、Br2 三种物质氧化性由强到弱的顺序是
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列.从海水中提取食盐和溴的过程如下:
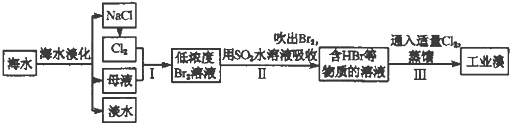
(1)请列举海水淡化的两种方法: 、 .
(2)把溴吹出的气体X,工业上最适宜选用 .A.NH3 B.空气 C.氩气 D.C02
(3)步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 .
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 .
(5)用气体X把溴吹出,而不直接利用有机溶剂把溴萃取出来,你认为其中的理由是
(6)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,绘制了装置简图:
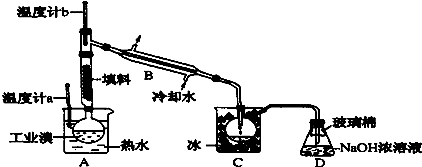
请你参与分析讨论:
①图中仪器B的名称: .
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 .
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
④C中液体产物颜色为 ,为除去该产物中仍残留的少量C12,可向其中加入NaBr溶液,充分反应后,再进行分离的操作是 .
查看习题详情和答案>>

(1)请列举海水淡化的两种方法:
(2)把溴吹出的气体X,工业上最适宜选用
(3)步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
(5)用气体X把溴吹出,而不直接利用有机溶剂把溴萃取出来,你认为其中的理由是
(6)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,绘制了装置简图:

请你参与分析讨论:
①图中仪器B的名称:
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
④C中液体产物颜色为