网址:http://m.1010jiajiao.com/timu3_id_66116[举报]
(1)高温电解技术能高效实现CO2(g) + H2O(g) =CO(g) + H2(g) +O2(g)? ,工作原理示意图如下:
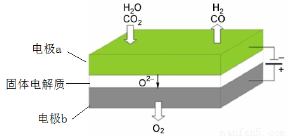
①电极b发生??????? (填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是?????????????????????????????? 。
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知: Cu2O + 2H+? = Cu + Cu2+ + H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
①固体混合物A中的成分是???????????? 。
②反应Ⅰ完成后,铁元素的存在形式为??????????? 。(填离子符号)
请写出生成该离子的离子方程式??????????????????????????????????????? 。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是????????????? 。
④下列关于NaClO调pH的说法正确的是???????? (填序号)。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
⑤实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为????????? 。
查看习题详情和答案>>
下列离子方程式错误的是( )
A.二氧化锰跟浓盐酸共热制Cl2:
MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.向漂白粉溶液中通入足量CO2:
ClO-+CO2+H2O![]() HClO+HCO
HClO+HCO![]()
C.向石灰乳中通氯气制漂粉精:
2OH-+Cl2![]() ClO-+Cl-+H2O
ClO-+Cl-+H2O
D.盐酸与石灰石制CO2:
CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
A.向氢氧化钠溶液中滴加同浓度的少量碳酸氢钙溶液
Ca2++![]() +OH-
+OH-![]() CaCO3↓+H2O
CaCO3↓+H2O
B.用氨水吸收少量的二氧化硫:NH3·H2O+SO2![]()
![]() +
+![]()
C.明矾溶液跟过量的氢氧化钠溶液反应:Al3++4OH-![]() [Al(OH)4]-
[Al(OH)4]-
D.次氯酸钙溶液中通入过量的二氧化硫:ClO-+SO2+H2O![]() HClO+
HClO+![]()
 HClO + OH-是酸碱反应
HClO + OH-是酸碱反应