摘要:5.(1)2MgO·3SiO2·nH2O,2MgO·3SiO2·nH2O+4H+=2Mg2++3H2SiO3+(n-1)H2O (3)①高锰酸钾.作消毒剂,②硫酸亚铁.补血剂,③3%双氧水.注射前消毒杀菌,④氟化钠.有固齿防龋功效,⑤0.9%氯化钠.生理盐水,⑥七水硫酸锌.作收敛剂.等. (4)① ② ③ (苯酚可以由苯与Cl2反应生成氯苯.再在一定条件下氯苯水解生成苯酚.反应方程式略)
网址:http://m.1010jiajiao.com/timu3_id_66015[举报]
(2011?宁波模拟)“化学与生活”模块
有下列常用药:
A:阿司匹林(乙酰水杨酸)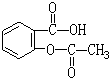
B:阿莫西林(羟氨苄青霉素)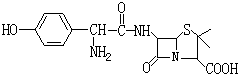
C:磺胺SN(对氨基苯磺酰胺)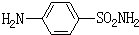
D:胃舒平(复方氢氧化铝)
(1)以上常用药中属于抗酸类药物的是
(2)一些抗酸类药物常会引起便秘副作用,所以常在其中添加能引起轻泻的药物,如三硅酸镁(2MgO?3SiO2?nH2O),三硅酸镁也有一定的抗酸作用,请写出三硅酸镁和胃酸(HCl)反应的化学方程式
(3)阿司匹林是由水杨酸(邻羟基苯甲酸)和乙酸酐(CH3CO)2O在浓硫酸存在的条件下,加热而制成的,请写出该反应的化学方程式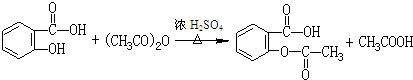
 .
.
(4)写出阿司匹林在氢氧化钠溶液中水解的化学方程式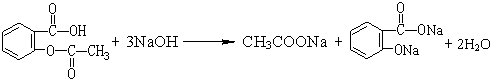
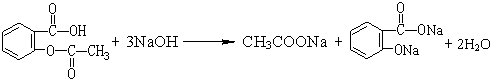 .
.
查看习题详情和答案>>
有下列常用药:
A:阿司匹林(乙酰水杨酸)

B:阿莫西林(羟氨苄青霉素)

C:磺胺SN(对氨基苯磺酰胺)

D:胃舒平(复方氢氧化铝)
(1)以上常用药中属于抗酸类药物的是
D
D
(填编号字母,下同);属于解热镇痛类药物的是A
A
;属于抗生素类药物的是B
B
.购买时无需医师处方的药物叫非处方药,英文缩写为OTC
OTC
.(2)一些抗酸类药物常会引起便秘副作用,所以常在其中添加能引起轻泻的药物,如三硅酸镁(2MgO?3SiO2?nH2O),三硅酸镁也有一定的抗酸作用,请写出三硅酸镁和胃酸(HCl)反应的化学方程式
2MgO?3SiO2?nH2O+4HCl═2MgCl2+3SiO2?nH2O+2H2O或2MgO?3SiO2?nH2O+4HCl═2MgCl2+3SiO2+(2+n)H2O
2MgO?3SiO2?nH2O+4HCl═2MgCl2+3SiO2?nH2O+2H2O或2MgO?3SiO2?nH2O+4HCl═2MgCl2+3SiO2+(2+n)H2O
.(3)阿司匹林是由水杨酸(邻羟基苯甲酸)和乙酸酐(CH3CO)2O在浓硫酸存在的条件下,加热而制成的,请写出该反应的化学方程式


(4)写出阿司匹林在氢氧化钠溶液中水解的化学方程式
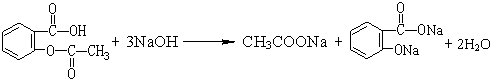
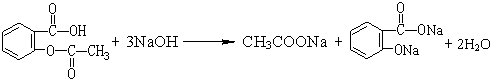
在某澄清、透明的浅黄色溶液中,可能含有K+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、Cl-离子.进行下述实验(所加试剂均过量).

(1)气体A的化学式是
(2)待测液中一定存在
(3)写出溶液C与过量氨水主要发生的反应的离子方程式
(4)三硅酸镁被用来治疗胃酸过多的胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久.把三硅酸镁(Mg2Si3O8?nH2O)改写成氧化物的形式为
查看习题详情和答案>>

(1)气体A的化学式是
NH3
NH3
,沉淀A的化学式是Fe(OH)3
Fe(OH)3
;(2)待测液中一定存在
NH4+、Al3+、Fe3+、SO42-;
NH4+、Al3+、Fe3+、SO42-;
;一定不存在Ba2+、HCO3-
Ba2+、HCO3-
;(3)写出溶液C与过量氨水主要发生的反应的离子方程式
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
.(4)三硅酸镁被用来治疗胃酸过多的胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久.把三硅酸镁(Mg2Si3O8?nH2O)改写成氧化物的形式为
2MgO?3SiO2?nH2O
2MgO?3SiO2?nH2O
,它中和胃酸(HCl)的离子方程式是:2MgO?3SiO2?nH2O+4H+=2Mg2++3H2SiO3+(n-1)H2O
2MgO?3SiO2?nH2O+4H+=2Mg2++3H2SiO3+(n-1)H2O
.三硅酸镁(2MgO?3SiO2?nH2O)可用于治疗胃溃疡,已知该物质的溶解度小(属不溶性化合物),当胃酸的酸度大于溃疡部分所能承受的酸度时,三硅酸镁有明显的反应.
(1)写出三硅酸镁与盐酸反应的化学方程式
(2)与其他药物相比,三硅酸镁的主要优点是 .
查看习题详情和答案>>
(1)写出三硅酸镁与盐酸反应的化学方程式
(2)与其他药物相比,三硅酸镁的主要优点是
(2010?上海)胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8.nH2O)等化合物.
1)三硅酸镁的氧化物形式为
2)铝元素的原子核外共有
3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径
4)Al2O3、MgO和SiO2都可以制耐火材料,其原因是
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点.
查看习题详情和答案>>
1)三硅酸镁的氧化物形式为
2MgO.3SiO2.nH2O
2MgO.3SiO2.nH2O
,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为1s22s1
1s22s1
.2)铝元素的原子核外共有
13
13
种不同运动状态的电子、5
5
种不同能级的电子.3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径
大
大
(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
4)Al2O3、MgO和SiO2都可以制耐火材料,其原因是
ad
ad
.a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点.