题目内容
(2010?上海)胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8.nH2O)等化合物.
1)三硅酸镁的氧化物形式为
2)铝元素的原子核外共有
3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径
4)Al2O3、MgO和SiO2都可以制耐火材料,其原因是
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点.
1)三硅酸镁的氧化物形式为
2MgO.3SiO2.nH2O
2MgO.3SiO2.nH2O
,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为1s22s1
1s22s1
.2)铝元素的原子核外共有
13
13
种不同运动状态的电子、5
5
种不同能级的电子.3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径
大
大
(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
4)Al2O3、MgO和SiO2都可以制耐火材料,其原因是
ad
ad
.a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点.
分析:1)硅酸盐用氧化物的形式来表示组成的书写顺序是:活泼金属氧化物→较活泼金属氧化物→非金属氧化物→二氧化硅→水,并将氧化物的数目用阿拉伯数字在其前面表示.比如斜长石KAlSi3O8:K2O?Al2O3?6SiO2;符合对角线规则的元素一般是某些主族元素与右下方的主族元素,如图所示: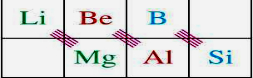 ,由此可推出与镁性质相似的元素,根据构造原理写出该元素原子的电子排布式;
,由此可推出与镁性质相似的元素,根据构造原理写出该元素原子的电子排布式;
2)电子的运动状态由能层、能级、原子轨道和电子的自旋状态共同决定,没有运动状态完全相同的电子存在;根据能级和能层的关系即可确定能级的数目;
3)根据半径的变化规律来确定元素,利用物质之间的反应来写出反应的离子方程式;
4)根据耐火材料的特点来选择.
 ,由此可推出与镁性质相似的元素,根据构造原理写出该元素原子的电子排布式;
,由此可推出与镁性质相似的元素,根据构造原理写出该元素原子的电子排布式;2)电子的运动状态由能层、能级、原子轨道和电子的自旋状态共同决定,没有运动状态完全相同的电子存在;根据能级和能层的关系即可确定能级的数目;
3)根据半径的变化规律来确定元素,利用物质之间的反应来写出反应的离子方程式;
4)根据耐火材料的特点来选择.
解答:解:1)根据胃舒平中三硅酸镁的化学式和书写方法,表示为:2MgO.3SiO2.nH2O.与镁元素在不同周期但相邻一族的元素,其符合对角线规则,故其是Li,其核外电子排布为:1s22s1.
故答案为:2MgO.3SiO2.nH2O;1s22s1.
2)铝元素原子的核外共有13个电子,其每一个电子的运动状态都不相同,故共有13种;有1s、2s、2p、3s、3p共5个能级.
故答案为:13;5.
3)与铝元素同周期且原子半径大于镁的元素是钠,其离子半径大于铝的离子半径;两者氢氧化物反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O;
故答案为:大;Al(OH)3+OH-═AlO2-+2H2O.
4)分析三种氧化物,可知三者都不溶于水且都具有很高的熔点.
故答案为:ad.
故答案为:2MgO.3SiO2.nH2O;1s22s1.
2)铝元素原子的核外共有13个电子,其每一个电子的运动状态都不相同,故共有13种;有1s、2s、2p、3s、3p共5个能级.
故答案为:13;5.
3)与铝元素同周期且原子半径大于镁的元素是钠,其离子半径大于铝的离子半径;两者氢氧化物反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O;
故答案为:大;Al(OH)3+OH-═AlO2-+2H2O.
4)分析三种氧化物,可知三者都不溶于水且都具有很高的熔点.
故答案为:ad.
点评:此题考查了硅化合物、元素周期表、原子的核外电子排布、原子的核外电子运动状态、元素周期律等知识;书写成氧化物形式时,要注意各氧化物之间用“?”相连,书写电子排布式时要注意要求:是写原子的电子排布式还是价电子排布式.没有运动状态完全相同的电子存在,因此原子的电子数有多少,就有多少种运动状态.理解能级、能层、原子轨道等概念的关系,才能顺利解决类此问题.

练习册系列答案
相关题目