摘要:8Al+3Fe3O44Al2O3+9Fe ②负 生成白色沉淀 Fe-2e-+2OH-===Fe(OH)2 ↓ ③4Fe(OH)2+O2+2H2O===4Fe(OH)3 (3)FeaOb [解析](1)R为Fe.Fe在X(O2)中燃烧生成甲(Fe3O4).Fe3O4在高温下与Al发生铝热反应生成Fe和Al2O3:8Al + 3Fe3O44Al2O3+ 9Fe. 2易被O2氧化.所以配制NaCl.NaOH混合液中需通过加热煮沸的方法除去溶解在溶液中的O2. ②R与电源正极相连.失去电子产生Fe2+.所以石墨应连接电源的负极.Fe失去电子生成的Fe2+与溶液中的OH―反应生成白色的Fe(OH)2沉淀.其电极反应为:Fe-2e-+2OH―===Fe(OH)2↓. ③Fe(OH)2被空气中的O2氧化生成红褐色的Fe(OH)3:4Fe(OH)2+ O2+2H2O===4Fe(OH)3↓. (3)R的氧化物与Al发生铝热反应后生成的Fe与盐酸反应产生H2(假设为a mol).等量的R的氧化物和Al粉混合物与NaOH溶液反应时.Al与NaOH溶液反应产生H2(假设为b mol).根据Fe-H2.Al-1.5H2.Al-1.5O.可得R中含有a mol Fe.b mol O.故R的化学式为FeaOb.
网址:http://m.1010jiajiao.com/timu3_id_65923[举报]
 图中,P为可自由滑动的活塞,关闭K,V(A)=aL,V(B)=0.8aL(连通管的体积忽略不计).在相同温度和有催化剂存在的条件下,分别向容器A、B中各充入1molN2和3molH2,发生反应N2(g)+3H2(g)
图中,P为可自由滑动的活塞,关闭K,V(A)=aL,V(B)=0.8aL(连通管的体积忽略不计).在相同温度和有催化剂存在的条件下,分别向容器A、B中各充入1molN2和3molH2,发生反应N2(g)+3H2(g)  2NH3(g);△H=-92.4kJ/mol.达到平衡后,V(B)=0.6aL.
2NH3(g);△H=-92.4kJ/mol.达到平衡后,V(B)=0.6aL.(1)B中N2的转化率是
50%
50%
.A中N2的转化率小于
小于
(填“大于”、“等于”或“小于”)B中N2的转化率.理由是A容积不变,而B容积缩小,所以A中容器压强小于B中压强,平衡向逆反应方向移动
A容积不变,而B容积缩小,所以A中容器压强小于B中压强,平衡向逆反应方向移动
.(2)打开K,一段时间后反应再次达到平衡,则B的体积为
0.2aL(打开K达到平衡时,平衡体系的组成与原B容器中相同,此时容器的总体积为原B平衡时体积的2倍,即1.2aL,故B的体积0.2aL)
0.2aL(打开K达到平衡时,平衡体系的组成与原B容器中相同,此时容器的总体积为原B平衡时体积的2倍,即1.2aL,故B的体积0.2aL)
.请说明理由?(3)A反应达到平衡时,放出akJ的热量,若向A中充入2molNH3,在相同条件下达到平衡时吸收热量为bkJ,则a和b的关系是
a+b=92.4
a+b=92.4
.(4)B中反应达到平衡后,只改变下列条件,c(NH3)不改变的是
CD
CD
(填序号).A.升高温度
B.向容器充入1molAr(g)
C.向容器中充入2molNH3
D.选用效果更好的催化剂.
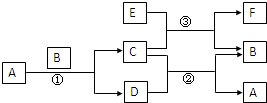 右图中所涉及的A、B、C、D、E、F和G都是中学化学教材中常见的物质.E为铝;B、D为单质,其余为化合物;反应①②③均在高温下进行且均为置换反应;A在常温下为液态,C有磁性,E、F既能溶于NaOH又能溶于HCl.
右图中所涉及的A、B、C、D、E、F和G都是中学化学教材中常见的物质.E为铝;B、D为单质,其余为化合物;反应①②③均在高温下进行且均为置换反应;A在常温下为液态,C有磁性,E、F既能溶于NaOH又能溶于HCl.(1)写出反应①的化学方程式
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
;
| ||
(2)写出E与NaOH溶液反应的离子方程式
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
;(3)用离子方程式表示F既能溶于NaOH又能溶于HCl的原因
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
、Al2O3+6H+=2Al3++3H2O
Al2O3+6H+=2Al3++3H2O
;(4)已知:C、E的混合物在工业上可用于钢轨焊接,请尝试写出反应③的化学方程式:
3Fe3O4+8Al
4Al2O3+9Fe
| ||
3Fe3O4+8Al
4Al2O3+9Fe
.
| ||
(2009?西城区一模)M、R都是生活中常见的金属单质,其中R是用量最多的金属.甲、乙是化合物,其中甲是黑色晶体,可由R在X中燃烧得到.
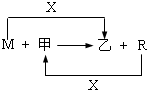
(1)M与甲在高温下反应的化学方程式是
(2)电解法制R低价氢氧化物的装置如图.a是4mol?L-1NaCl、1mol?L-1NaOH的混合溶液.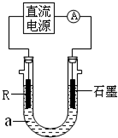
①配制a时需要除去蒸馏水中溶解的O2,常采用
②石墨电极应与电源的
③停止实验一段时间后,在R极上部有红褐色物质产生,反应的化学方程式是
(3)把R的某氧化物粉末与M粉末混合后分成两等份.一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应.前后两种情况下生成的气体质量比是a:b,则R的氧化物的化学式是
查看习题详情和答案>>

(1)M与甲在高温下反应的化学方程式是
8Al+3Fe3O4
4Al2O3+9Fe
| ||
8Al+3Fe3O4
4Al2O3+9Fe
.
| ||
(2)电解法制R低价氢氧化物的装置如图.a是4mol?L-1NaCl、1mol?L-1NaOH的混合溶液.

①配制a时需要除去蒸馏水中溶解的O2,常采用
煮沸
煮沸
的方法.②石墨电极应与电源的
负
负
(填“正”或“负”)极相连接,通电后,R电极附近的现象是生成白色沉淀
生成白色沉淀
,R极的电极反应式是Fe-2e-+2OH-=Fe(OH)2↓
Fe-2e-+2OH-=Fe(OH)2↓
.③停止实验一段时间后,在R极上部有红褐色物质产生,反应的化学方程式是
4Fe(OH)2 +O2+2H2O═4Fe(OH)3
4Fe(OH)2 +O2+2H2O═4Fe(OH)3
.(3)把R的某氧化物粉末与M粉末混合后分成两等份.一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应.前后两种情况下生成的气体质量比是a:b,则R的氧化物的化学式是
FeaOb
FeaOb
.如图1中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去).其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应.

回答下列问题:
(1)组成单质Y的元素在周期表中的位置是
M中存在的化学键类型为
R的化学式是
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为
 .
.
(3)已知A与1molAl反应转化为X时(所有物质均为固体).放出a KJ热量.写出该反应的热化学方程式:
(4)写出A和D的稀溶液反应生成G的离子方程式:
若转移0.6mol电子,生成的气体在标况下体积为
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量.假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值.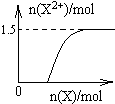
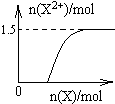 .
.
查看习题详情和答案>>

回答下列问题:
(1)组成单质Y的元素在周期表中的位置是
第二周期第ⅥA族
第二周期第ⅥA族
;M中存在的化学键类型为
离子键和共价键
离子键和共价键
;R的化学式是
H2SiO3(H4SiO4)
H2SiO3(H4SiO4)
.(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为


(3)已知A与1molAl反应转化为X时(所有物质均为固体).放出a KJ热量.写出该反应的热化学方程式:
8Al(s)+3Fe3O4(s)═9Fe(s)+4Al2O3(s)△H=-8akJ/mol
8Al(s)+3Fe3O4(s)═9Fe(s)+4Al2O3(s)△H=-8akJ/mol
.(4)写出A和D的稀溶液反应生成G的离子方程式:
3Fe3O4+28H++NO3-═9Fe3++14H2O+NO↑
3Fe3O4+28H++NO3-═9Fe3++14H2O+NO↑
;若转移0.6mol电子,生成的气体在标况下体积为
4.48升
4.48升
.(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量.假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值.
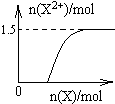
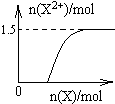
 A~I分别表示中学化学中常见的一种物质,它们之间相互转化关系如图所示(部分反应物、生成物没有列出),且已知A、B、C、D、E、F六种物质中均含同一种元素,A、I是两种常见的金属单质.H在常温下是一种常见的非金属气态单质.
A~I分别表示中学化学中常见的一种物质,它们之间相互转化关系如图所示(部分反应物、生成物没有列出),且已知A、B、C、D、E、F六种物质中均含同一种元素,A、I是两种常见的金属单质.H在常温下是一种常见的非金属气态单质.请填写下列空白:
(1)写出C、G物质的化学式.
C
FeCl2
FeCl2
G
Al2O3
Al2O3
(2)写出反应①、⑥的化学方程式和反应④的离子方程式.
反应①:
3Fe3O4+8AL
9Fe+4Al2O3
| ||
3Fe3O4+8AL
9Fe+4Al2O3
| ||
该反应通常叫做
铝热
铝热
反应.反应⑥:
4Fe(OH)2+2H2O+O2=4Fe(OH)3
4Fe(OH)2+2H2O+O2=4Fe(OH)3
反应④:
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
.