摘要:(三)特殊物质中的原子.离子 48.在标准状况下.2g氖气含有NA个氖原子( ) 49.62 g白磷中含有2 NA个磷原子( ) 50.1molNa2O2含有阴阳离子总数为4NA( ) 51.1mol固体NaHSO4含有阴阳离子总数为2NA( ) 52.1molMgCl2中含有的离子数为2NA( )
网址:http://m.1010jiajiao.com/timu3_id_65883[举报]
氧化还原反应中,物质的原子得电子,则元素的化合价________,被________,发生________反应,变成________产物,则该物质是________剂,具有________性;物质中的原子失电子,则元素化合价________,被________,发生反应________,变成________产物,则该物质是________剂,具有________性。
查看习题详情和答案>>
下列物质中的原子的杂化轨道类型和分子的立体构型对应有错误的是
[ ]
A.BeCl2中的Be,sp,直线形
B.SiF4中的Si,sp3,正四面体形
C.BCl3中的B,sp2,平面三角形
D.C6H6中的C,sp,平面正六边形
查看习题详情和答案>>
B.SiF4中的Si,sp3,正四面体形
C.BCl3中的B,sp2,平面三角形
D.C6H6中的C,sp,平面正六边形
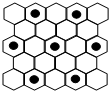 下表列出了前20号元素中的某些元素性质的有关数据:
下表列出了前20号元素中的某些元素性质的有关数据:| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为
《物质结构与性质》
均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6.A和C分子中的原子个数比为1:1,B和D分子中的原子个数比为1:2.D可作为火箭推进剂的燃料.请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为 (用元素符号回答).
(2)A与HF相比,其熔、沸点较低,原因是 .
(3)B分子的空间构型为 形,该分子属于 分子.(填“极性”或“非极性”)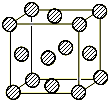
(4)C为一种绿色氧化剂,有广泛应用.请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式 ,该反应中反应物Cu原子的基态电子排布式为 .铜晶体中铜原子的堆积方式为面心立方堆积,如图是铜晶体一个晶胞的示意图,则晶胞中含 个铜原子.
(5)D分子中心原子的杂化方式是 ,由该原子组成的单质分子中包含
个π键,与该单质分子互为等电子体的常见分子的分子式为 .
查看习题详情和答案>>
均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6.A和C分子中的原子个数比为1:1,B和D分子中的原子个数比为1:2.D可作为火箭推进剂的燃料.请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为
(2)A与HF相比,其熔、沸点较低,原因是
(3)B分子的空间构型为

(4)C为一种绿色氧化剂,有广泛应用.请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式
(5)D分子中心原子的杂化方式是
[化学--选修3物质结构与性质]A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能 级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最 小的元素;E的最高价氧化物的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余 能层均充满电子.G元素与D元素同主族,且相差3个周期.
(1)元素A、B、C的第一电离能由小到大的是 用元素符号表示).
(2)E的最高价含氧酸中E的杂化方式为 .
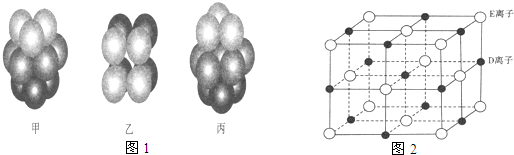
(3)F原子的外围电子排布式为 ,F的晶体中原子的堆积方式是如图1中的 (填写“甲”、“乙”或“丙”).
(4)DE,GE两种晶体,都属于离子晶体,但配位数不同,其原因是
(5)已知DE晶体的晶胞如图2所示若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小 立方体”中心各放置一个A原子,且这4个“小立方体”不相邻.位于“小立方体”中的A原 子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A-A键的键长 为a cm,NA表示阿伏加德罗常数),则该晶胞中含有 个A原子,该晶体的密度是 g?cm-3.
查看习题详情和答案>>

(1)元素A、B、C的第一电离能由小到大的是
(2)E的最高价含氧酸中E的杂化方式为
(3)F原子的外围电子排布式为
(4)DE,GE两种晶体,都属于离子晶体,但配位数不同,其原因是
(5)已知DE晶体的晶胞如图2所示若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小 立方体”中心各放置一个A原子,且这4个“小立方体”不相邻.位于“小立方体”中的A原 子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A-A键的键长 为a cm,NA表示阿伏加德罗常数),则该晶胞中含有