题目内容
 下表列出了前20号元素中的某些元素性质的有关数据:
下表列出了前20号元素中的某些元素性质的有关数据:| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
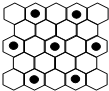
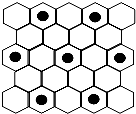
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为
分析:①②⑧最高正价为+1,为第IA族元素,原子半径都大于⑩原子半径,结合原子半径可知,①是Li元素、②是K元素、⑧是Na元素;
⑦⑩最低价为-1,为第VIIA族元素,⑦的原子半径大于⑩,所以⑦是Cl元素、⑩是F元素;
③只有-2价,没有正化合价,为第VIA族元素,则③是O元素;
④只有+3价,为第IIIA族元素,原子半径大于Cl原子半径,所以④是Al元素;
⑤有+4、-4价,为第IVA族元素,原子半径小于Cl原子半径,所以⑤是C元素;
⑥⑨有+5、-3价,为第VA族元素,⑥的原子半径大于⑨,则⑥是P元素、⑨是N元素;
结合物质的性质分析解答.
⑦⑩最低价为-1,为第VIIA族元素,⑦的原子半径大于⑩,所以⑦是Cl元素、⑩是F元素;
③只有-2价,没有正化合价,为第VIA族元素,则③是O元素;
④只有+3价,为第IIIA族元素,原子半径大于Cl原子半径,所以④是Al元素;
⑤有+4、-4价,为第IVA族元素,原子半径小于Cl原子半径,所以⑤是C元素;
⑥⑨有+5、-3价,为第VA族元素,⑥的原子半径大于⑨,则⑥是P元素、⑨是N元素;
结合物质的性质分析解答.
解答:解:①②⑧最高正价为+1,为第IA族元素,原子半径都大于⑩原子半径,结合原子半径可知,①是Li元素、②是K元素、⑧是Na元素;
⑦⑩最低价为-1,为第VIIA族元素,⑦的原子半径大于⑩,所以⑦是Cl元素、⑩是F元素;
③只有-2价,没有正化合价,为第VIA族元素,则③是O元素;
④只有+3价,为第IIIA族元素,原子半径大于Cl原子半径,所以④是Al元素;
⑤有+4、-4价,为第IVA族元素,原子半径小于Cl原子半径,所以⑤是C元素;
⑥⑨有+5、-3价,为第VA族元素,⑥的原子半径大于⑨,则⑥是P元素、⑨是N元素;
(1)同周期自左而右元素第一电离能呈增大趋势,同主族自上而下第一电离能减小,故以上10种元素的原子中,失去核外第一个电子所需能量最少的是金属性最强的元素K,
故答案为:②;
(2)⑤是C元素、⑥是P元素、⑦是Cl元素,⑤、⑥、⑦三种元素中的两种元素形成的化合物有PCl3、CCl4、PCl5,元素化合价的绝对值+其最外层电子数=8,则该原子达到8电子稳定结构,所以每个原子都满足最外层为8电子稳定结构的物质的化学式为 PCl3、CCl4;
某元素R的原子半径为1.02×10-10m,该原子半径在⑥⑦之间,⑥是P元素,⑦是Cl元素,则该元素是S元素,处于第三周期ⅥA族;若物质Na2S3是一种含有非极性共价键的离子化合物,存在S32-离子,离子中S原子之间形成1对共用电子对且都满足8电子稳定结构,故该化合物的电子式为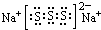 ,
,
故答案为:PCl3、CCl4;第三周期ⅥA族;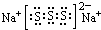 ;
;
(4)⑤是C元素,②是K元素,如图所示,K原子镶嵌在正六边形的中心,该正六边形周围有6个未镶嵌K原子的C原子正六边形结构,即每正六边形周围连接6个C原子,该碳原子为3个正六边形共有,故结构中K原子与C原子数目之比为1:(6+6×
)=8,故化学式为KC8,
故答案为:KC8.
⑦⑩最低价为-1,为第VIIA族元素,⑦的原子半径大于⑩,所以⑦是Cl元素、⑩是F元素;
③只有-2价,没有正化合价,为第VIA族元素,则③是O元素;
④只有+3价,为第IIIA族元素,原子半径大于Cl原子半径,所以④是Al元素;
⑤有+4、-4价,为第IVA族元素,原子半径小于Cl原子半径,所以⑤是C元素;
⑥⑨有+5、-3价,为第VA族元素,⑥的原子半径大于⑨,则⑥是P元素、⑨是N元素;
(1)同周期自左而右元素第一电离能呈增大趋势,同主族自上而下第一电离能减小,故以上10种元素的原子中,失去核外第一个电子所需能量最少的是金属性最强的元素K,
故答案为:②;
(2)⑤是C元素、⑥是P元素、⑦是Cl元素,⑤、⑥、⑦三种元素中的两种元素形成的化合物有PCl3、CCl4、PCl5,元素化合价的绝对值+其最外层电子数=8,则该原子达到8电子稳定结构,所以每个原子都满足最外层为8电子稳定结构的物质的化学式为 PCl3、CCl4;
某元素R的原子半径为1.02×10-10m,该原子半径在⑥⑦之间,⑥是P元素,⑦是Cl元素,则该元素是S元素,处于第三周期ⅥA族;若物质Na2S3是一种含有非极性共价键的离子化合物,存在S32-离子,离子中S原子之间形成1对共用电子对且都满足8电子稳定结构,故该化合物的电子式为
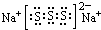 ,
,故答案为:PCl3、CCl4;第三周期ⅥA族;
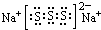 ;
;(4)⑤是C元素,②是K元素,如图所示,K原子镶嵌在正六边形的中心,该正六边形周围有6个未镶嵌K原子的C原子正六边形结构,即每正六边形周围连接6个C原子,该碳原子为3个正六边形共有,故结构中K原子与C原子数目之比为1:(6+6×
| 1 |
| 3 |
故答案为:KC8.
点评:本题考查较综合,涉及性质结构位置关系应用、元素周期律、晶胞结构与计算、电子式等知识点,根据元素周期律判断元素是解本题关键,(4)中化学式的确定是难点,注意利用均摊法分析解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下表列出了前20号元素中的某些元素性质的有关数据:
元素编号元素性质 | ① | ② | ③ | ④ | ⑤ |
原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 |
最高价态 | +1 | +1 | — | +3 | +4 |
最低价态 | — | — | -2 | — | -4 |
元素编号元素性质 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
最高价态 | +5 | +7 | +1 | +5 | — |
最低价态 | -3 | -1 | — | -3 | -1 |
试完成下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是_________(填写编号)。
(2)上述⑤⑥⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)____________________________。某元素R的原子半径为1.02×10-10 m,该元素在周期表中位于_______________;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式_________________。
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②的单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如下图所示,该物质的化学式为_________________。

(8分)下表列出了前20号元素中的某些元素性质的有关数据:
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10—10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | — |
| 最低价态 | — | — | -2 | — | -4 | -3 | -1 | — | -3 | -1 |
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是 、 (写两种分子的分子式)。某元素R的原子半径为1.02×10—10m,该元素在周期表中的位置是 ;电解⑧和R的某种熔融化合物时,当阴极消耗 2 mol 该化合物的正离子时,阳极可得3 mol单质,。由此可推断得知该盐的化学式是 (填化学式)。其阳极上所发生的电极方程式是:__________________________________。
 下表列出了前20号元素中的某些元素性质的有关数据:
下表列出了前20号元素中的某些元素性质的有关数据: 02×10-10m,该元素在周期表中位于 ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。
02×10-10m,该元素在周期表中位于 ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。