摘要:9.某学生设计了如图所示的方法.鉴定盐A的组成成分.由此分析.下列结论中.正确的是( ) A.A中一定有Fe3+ B.C中一定有Fe3+ C.B为AgI沉淀 D.A一定为FeI3溶液
网址:http://m.1010jiajiao.com/timu3_id_65536[举报]
 某学生设计了如图所示的装置进行实验,各装置中所装试剂、实验操作及实验现象如下:
某学生设计了如图所示的装置进行实验,各装置中所装试剂、实验操作及实验现象如下:Ⅰ.装置中所装的试剂是:①A瓶装无水乙醇,内放无水盐X;②B干燥管中装生石灰;③C和D中都装浓硫酸;④E瓶中装入试剂Y
Ⅱ.实验操作及现象是:用水浴加热A瓶;将D中浓硫酸缓缓滴入E中与试剂Y作用;发现C中导管有大量气泡放出;A瓶内X逐渐变色,从B管挥发出的气体可点燃.
请回答下列问题:
(1)E瓶中所装的试剂Y是
c
c
(填写编号)a.饱和食盐水 b.MnO2和NaCl的混合物 c.浓盐酸
(2)C中浓H2SO4所起的作用是
干燥HCl气体
干燥HCl气体
,D瓶中浓H2SO4所起的作用是吸收浓盐酸中混有的水分,浓H2SO4溶于水放热,有利于HCl气体逸出
吸收浓盐酸中混有的水分,浓H2SO4溶于水放热,有利于HCl气体逸出
.(3)A瓶中发生反应的化学方程式是
CH3CH2OH+HCl
CH3CH2Cl+H2O
| △ |
CH3CH2OH+HCl
CH3CH2Cl+H2O
,反应类型是| △ |
取代反应
取代反应
,所生成的氯乙烷
氯乙烷
(写名称)在B出口处点燃.(4)无水盐X宜选用
无水CuSO4
无水CuSO4
,它能起指示剂作用的原因是实验过程中观察到无水CuSO4由白变蓝,说明反应中有水生成,与CuSO4结合生成CuSO4?5H2O
实验过程中观察到无水CuSO4由白变蓝,说明反应中有水生成,与CuSO4结合生成CuSO4?5H2O
.(5)此实验能证明乙醇分子中含有氧原子的理由是
无水CuSO4变蓝证明了反应中一定有水生成,水中的氧元素不能来自于HCl,故只能由乙醇提供
无水CuSO4变蓝证明了反应中一定有水生成,水中的氧元素不能来自于HCl,故只能由乙醇提供
.(6)如果将装置中的C瓶去掉,实验目的是否能够达到?
不能
不能
(填“能”或“不能”),因为HCl挥发时带出水蒸气,若不除去,无法判定使无水CuSO4变蓝的水是否来自于乙醇
HCl挥发时带出水蒸气,若不除去,无法判定使无水CuSO4变蓝的水是否来自于乙醇
.为了将混有Na2SO4、NaHCO3的NaCl提纯,并制得纯净的NaCl溶液,某学生设计了如图所示的实验方案:

(1)操作①盛放药品可选用________。(填仪器名称)
(2)操作②为什么不用Ba(NO3)2溶液,其理由是
________________________________________。
(3)进行操作②后,如何判断SO![]() 已除尽?方法是________________________________。
已除尽?方法是________________________________。
(4)操作③的目的是_______;为何不先过滤后加Na2CO3溶液,其理由是________________。
(5)此设计方案是否严密?请说明理由________________。
查看习题详情和答案>>某学生设计了如图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹——“ ”。
”。
据此,下列叙述不正确的是( )
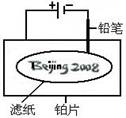
A.铅笔作阴极:电极反应为:2H+ + 2e- = H2↑
B.铂片作阳极:电极反应为:2Cl- - 2e- = Cl2↑
C.铅笔与滤纸接触处有少量Cl2逸出
D.上述反应总的离子方程式可表示为2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看习题详情和答案>>
某学生设计了如图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹——“ ”。
”。
据此,下列叙述不正确的是( )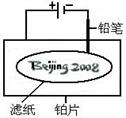
| A.铅笔作阴极:电极反应为:2H+ + 2e- = H2↑ |
| B.铂片作阳极:电极反应为:2Cl-- 2e- = Cl2↑ |
| C.铅笔与滤纸接触处有少量Cl2逸出 |
D.上述反应总的离子方程式可表示为2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
