网址:http://m.1010jiajiao.com/timu3_id_65193[举报]
反应2A(g)+B(g)![]() 2C(g);△H=akJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,Y的物质的量n(Y)与反应时间(t)的关系如下图所示,下列判断正确的是
2C(g);△H=akJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,Y的物质的量n(Y)与反应时间(t)的关系如下图所示,下列判断正确的是
 A.Y可能是A或B,a>0
A.Y可能是A或B,a>0
B.Y可能是A或B,a<0
C.Y一定是C,a>0
D.Y一定是C,a<0
查看习题详情和答案>>
反应2A(g)+B(g) 2C(g);△H=akJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,Y的物质的量n(Y)与反应时间(t)的关系如下图所示,下列判断正确的是
2C(g);△H=akJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,Y的物质的量n(Y)与反应时间(t)的关系如下图所示,下列判断正确的是
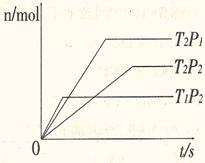 A.Y可能是A或B,a>0
A.Y可能是A或B,a>0
B.Y可能是A或B,a<0
C.Y一定是C,a>0
D.Y一定是C,a<0
查看习题详情和答案>>
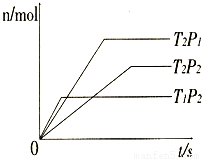
A.Y可能是A或B,a>0
B.Y可能是A或B,a<0
C.Y一定是C,a>0
D.Y一定是C,a<0
查看习题详情和答案>>
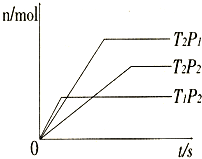 (2010?临沂一模)反应2A(g)+B(g)?2C(g);△H=akJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,Y的物质的量n(Y)与反应时间(t)的关系如图所示,下列判断正确的是( )
(2010?临沂一模)反应2A(g)+B(g)?2C(g);△H=akJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,Y的物质的量n(Y)与反应时间(t)的关系如图所示,下列判断正确的是( )(16分)向一定体积的密闭器中加入2 mol A、0.6 mo1 C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图(Ⅰ)所示,其中t0~t1 阶段c(B)未画出.图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.
请回答下列问题:
(1)若t1=15 min,则t0~t1阶段以C物质的浓度变化表示反应速率为 。
(2) t4~t5阶段改变的条件为 ,B的起始物质的量浓度为 ,各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
则K1= (保留两位小数),
K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接).
(3) t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为 .
【解析】(1)化学反应速率通常用单位时间内浓度的变化量来表示。根据图像I可知在15min内C的浓度变化量是0.6mol/L-0.3mol/L=0.3mol/L,所以速率为
(2)由图像Ⅱ可知,在t4~t5阶段反应速率减小,但平衡不移动,所以改变的条件不可能是温度和浓度,由于在t3~t4阶段为使用催化剂,所以该阶段只是降低压强。这说明改变压强平衡不移动,因此反应前后体积是不变的。根据图像I可知A是反应物,C是生成物,二者的变化量之比是2︰3,所以要使反应前后体积不变,B只是反应物,及反应的方程式为2A+B3C。C的浓度增加了0.3mol/L,则B的浓度减少了0.1mol/L,所以B的起始浓度是0.4mol/L+0.1mol/L=0.5mol/L。在t1~t2阶段平衡是ABC的浓度(mol/L)分别为0.8、0.4、0.6,所以平衡常数为
![]() 。因为平衡常数只与温度有关,根据图像可知在t5~t6阶段,正逆反应速率同时增大,但平衡向正反应方向移动,因为该条件只能是温度且是升高温度,所以反应是吸热反应,因此K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5。
。因为平衡常数只与温度有关,根据图像可知在t5~t6阶段,正逆反应速率同时增大,但平衡向正反应方向移动,因为该条件只能是温度且是升高温度,所以反应是吸热反应,因此K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5。
(3)根据题意科判断,每消耗0.01molA,反应就吸收能量akJ,所以反应的热化学方程式为2A(g)+B(g)⇋3C(g) △H=+200kJ/mol。
(4)因为容器容积不变(容器容积是2L),所以要使平衡等效,则起始物质的物质的量是相等的。根据题意可知起始时AB的物质的量分别为2.4mol和1.2mol,则把cmol的C转化为AB,则AB的物质的量(mol)分别是a+2c/3、b+c/3,所以关系式必须满足a+2c/3=2.4、b+c/3=1.2.
查看习题详情和答案>>