摘要:4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+ Ba2++SO42-=BaSO4↓
网址:http://m.1010jiajiao.com/timu3_id_65105[举报]
(2011?潍坊模拟)以下是有关SO2、Cl2的性质实验.
(1)某小组设计如图1所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.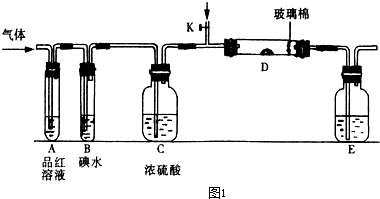
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)
A.氨水 B.稀盐酸 C.硝酸钾溶液 D.硫化钠溶液
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式
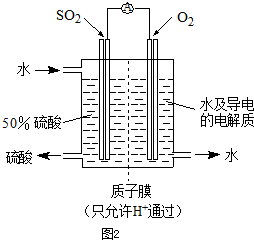
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图2,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.通入SO2的电极为
Ⅱ实验是化学研究的基础,关于下列各装置图的叙述正确的是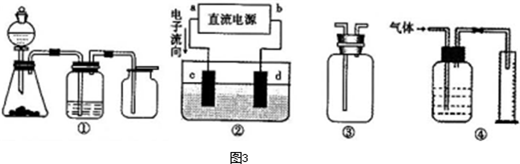
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正扳,d为阳极
C.装置③可用于收集H2、NH3、Cl2,、HCl、NO2等
D.装置④能用于测量气体体积
Ⅲ用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图4所示(a、b为石墨电极).下列说法中正确的是
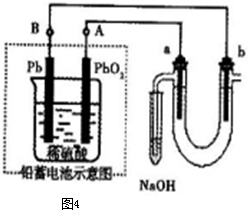
A.铅蓄电池负极的反应式为:Pb-2e-=Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-.
查看习题详情和答案>>
(1)某小组设计如图1所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.

①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?
相同
相同
(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
.
| ||
| △ |
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为
SO2+I2+2H2O=4H++2I-+SO42-
SO2+I2+2H2O=4H++2I-+SO42-
.(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)
B
B
,仍然无法观察到沉淀产生.A.氨水 B.稀盐酸 C.硝酸钾溶液 D.硫化钠溶液
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式
4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+
4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+
.(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图2,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.通入SO2的电极为
负
负
极,其电极反应式为SO2-2e-+2H2O=4H++SO42-
SO2-2e-+2H2O=4H++SO42-
;电池的总反应式2SO2+O2+2H2O=2H2SO4
2SO2+O2+2H2O=2H2SO4

Ⅱ实验是化学研究的基础,关于下列各装置图的叙述正确的是
C
C
(填序号)
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正扳,d为阳极
C.装置③可用于收集H2、NH3、Cl2,、HCl、NO2等
D.装置④能用于测量气体体积
Ⅲ用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图4所示(a、b为石墨电极).下列说法中正确的是
D
D
(填序号)
A.铅蓄电池负极的反应式为:Pb-2e-=Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-.
(一)现有以下物质:A:Na2O2 B:Al(OH)3 C:纯盐酸 D:CaClO?Cl E:O3 F:HF G:Fe(OH)3胶体 H:液氨
(1)属于氧化物的是:
(3)属于弱电解质的是:
(二)以下是有关SO2、Cl2的性质实验.
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.

若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?
(2)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式
查看习题详情和答案>>
(1)属于氧化物的是:
A
A
(2)属于混合物的是:CG
CG
(3)属于弱电解质的是:
BF
BF
(4)属于非电解质的是:H
H
(二)以下是有关SO2、Cl2的性质实验.
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.

若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?
相同
相同
(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
.
| ||
| △ |
(2)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式
4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+
4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+
.(2012?武汉模拟)某同学欲探究Na2S2O3的有关化学性质,设计如下实验流程图.

请回答下列问题:
(1)用pH试纸测定溶液pH的操作方法是:
(2)写出生成白色沉淀W所涉及的离子方程式:
(3)将上述流程中所加BaCl2溶液和氯水的顺序颠倒,也得到白色沉淀,能否说明该白色沉淀与 W 为同种物质
(4)取三支大小相同的试管,通过侧定Na2S2O3溶液与稀硫酸反应出现浑浊的时间,研究外界条件对化学反应速率的影响.设计实验表格如下:
①V=
②探究浓度对化学反应速率的影响,应选择
③为了准确控制反应的温度,应采用的加热方式为
查看习题详情和答案>>

请回答下列问题:
(1)用pH试纸测定溶液pH的操作方法是:
取一小段pH试纸于表面皿上,用洁净的玻璃棒蘸取待测溶液点在pH试纸中段,与比色卡对照,读出溶液的pH.
取一小段pH试纸于表面皿上,用洁净的玻璃棒蘸取待测溶液点在pH试纸中段,与比色卡对照,读出溶液的pH.
(2)写出生成白色沉淀W所涉及的离子方程式:
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,Ba2++SO42-=BaSO4↓
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,Ba2++SO42-=BaSO4↓
(3)将上述流程中所加BaCl2溶液和氯水的顺序颠倒,也得到白色沉淀,能否说明该白色沉淀与 W 为同种物质
否
否
(填“能”、“否”);(4)取三支大小相同的试管,通过侧定Na2S2O3溶液与稀硫酸反应出现浑浊的时间,研究外界条件对化学反应速率的影响.设计实验表格如下:
| 实验 序号 |
实验 温度/℃ |
0.1mol/LNa2S2O3溶液的体积/mL | H2O的 体积/mL |
0.1mol/LH2SO4溶液的体积/mL | 所需 时间/s |
| 甲 | 25 | 5 | 5 | 2 | / |
| 乙 | 25 | 5 | 6 | 1 | / |
| 丙 | 35 | 5 | 5 | V | / |
2
2
;②探究浓度对化学反应速率的影响,应选择
甲、乙
甲、乙
(填实验编号)组实验进行对比分析;③为了准确控制反应的温度,应采用的加热方式为
水浴加热
水浴加热
.(2011?珠海二模)硫代硫酸钠(Na2S2O3)俗称大苏打,主要用于照相业作定影剂.Na2S2O3易溶于水,在酸性溶液中会迅速分解,具有较强的还原性.
(1)Na2S2O3溶液与足量氯水反应的离子方程式为
(2)硫代硫酸钠(Na2S2O3)露置在空气中易氧化变质,其可能的变质后生成物如下:
假设一:
假设二:只有Na2SO4固体
假设三:
(3)现有一瓶Na2S2O3固体,可能混有Na2SO4固体.设计实验验证该假设,写出实验步骤、预期现象和结论.限选试剂:1mol?L-1 H2SO4、1mol?L-1HNO3、1mol?L-1HCl、1mol?L-1NaOH、0.1mol?L-1BaCl2、0.01mol?L-1KMnO4、蒸馏水.
查看习题详情和答案>>
(1)Na2S2O3溶液与足量氯水反应的离子方程式为
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
.(S元素被氧化为SO42-)(2)硫代硫酸钠(Na2S2O3)露置在空气中易氧化变质,其可能的变质后生成物如下:
假设一:
只有Na2SO3
只有Na2SO3
假设二:只有Na2SO4固体
假设三:
Na2SO4、Na2SO3都有
Na2SO4、Na2SO3都有
(3)现有一瓶Na2S2O3固体,可能混有Na2SO4固体.设计实验验证该假设,写出实验步骤、预期现象和结论.限选试剂:1mol?L-1 H2SO4、1mol?L-1HNO3、1mol?L-1HCl、1mol?L-1NaOH、0.1mol?L-1BaCl2、0.01mol?L-1KMnO4、蒸馏水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体于试管中,加蒸馏水溶解. | |
| 步骤2: 向试管中加入过量1 mol?L-1HCl溶液.充分振荡,静置. 向试管中加入过量1 mol?L-1HCl溶液.充分振荡,静置. |
有淡黄色沉淀生成. 有淡黄色沉淀生成. |
| 步骤3: 取上层清液于另一试管中,滴加少量0.1 mol?L-1BaCl2溶液. 取上层清液于另一试管中,滴加少量0.1 mol?L-1BaCl2溶液. |
有白色沉淀生成,证明固体中混有Na2SO4. 有白色沉淀生成,证明固体中混有Na2SO4. |
(2011?东城区二模)(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
其他条件不变时:探究浓度对化学反应速率的影响,应选择
探究温度对化学反应速率的影响,应选择
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是
甲同学设计如下实验流程探究Na2S2O3的化学性质.
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和
(Ⅱ)生成白色沉淀B的离子方程式是
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是
查看习题详情和答案>>
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
①②
①②
(填实验编号);探究温度对化学反应速率的影响,应选择
①④
①④
(填实验编号).(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
.甲同学设计如下实验流程探究Na2S2O3的化学性质.

(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和
还原
还原
性.(Ⅱ)生成白色沉淀B的离子方程式是
SO42-+Ba2+=BaSO4↓
SO42-+Ba2+=BaSO4↓
.(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是
乙
乙
(填“甲”或“乙”),理由是可以排除BaS2O3的干扰
可以排除BaS2O3的干扰
.