题目内容
(一)现有以下物质:A:Na2O2 B:Al(OH)3 C:纯盐酸 D:CaClO?Cl E:O3 F:HF G:Fe(OH)3胶体 H:液氨
(1)属于氧化物的是:
(3)属于弱电解质的是:
(二)以下是有关SO2、Cl2的性质实验.
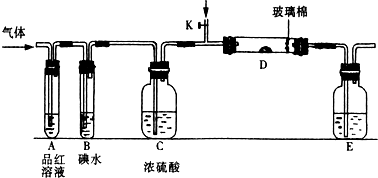
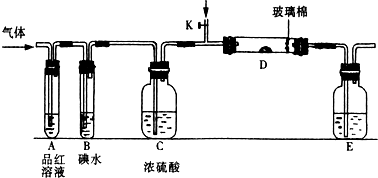
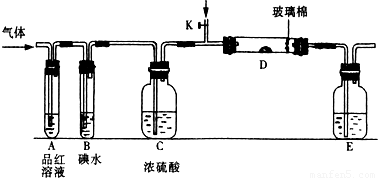
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.

若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?
(2)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式
(1)属于氧化物的是:
A
A
(2)属于混合物的是:CG
CG
(3)属于弱电解质的是:
BF
BF
(4)属于非电解质的是:H
H
(二)以下是有关SO2、Cl2的性质实验.
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.

若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?
相同
相同
(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
.
| ||
| △ |
(2)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式
4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+
4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+
.分析:(一)(1)由两种元素组成的化合物中,其中一种元素是氧元素,这样的化合物叫做氧化物;
(2)由两种或多种物质混合而成的,这些物质相互间没有发生反应,混合物里各物质都保持原来的性质;
(3)在水溶液里只有部分电离的电解质是弱电解质;
(4)在水溶液里或熔融状态下都不导电的化合物是非电解质;
(二)(1)根据SO2和Cl2的化学性质分析反应现象,从而判断反应现象是否相同;二氧化硫和氧气在五氧化二钒作催化剂、加热条件下能发生氧化还原反应;
(2)先根据X中元素的质量之比求出原子个数之比,再根据题中反应现象判断该反应生成的离子,由氧化还原反应写出离子方程式.
(2)由两种或多种物质混合而成的,这些物质相互间没有发生反应,混合物里各物质都保持原来的性质;
(3)在水溶液里只有部分电离的电解质是弱电解质;
(4)在水溶液里或熔融状态下都不导电的化合物是非电解质;
(二)(1)根据SO2和Cl2的化学性质分析反应现象,从而判断反应现象是否相同;二氧化硫和氧气在五氧化二钒作催化剂、加热条件下能发生氧化还原反应;
(2)先根据X中元素的质量之比求出原子个数之比,再根据题中反应现象判断该反应生成的离子,由氧化还原反应写出离子方程式.
解答:解:(一)(1)由两种元素组成的化合物中,其中一种元素是氧元素,这样的化合物叫做氧化物,所以由两种元素组成且其中一种元素为氧元素的化合物是Na2O2,故答案为:A;
(2)由两种或多种物质混合而成的,这些物质相互间没有发生反应,混合物里各物质都保持原来的性质;纯盐酸中氯化氢是溶质,水是溶剂,所以是混合物;氢氧化铁胶体是混合物,所以属于混合物的为CG,故答案为:CG;
(3)在水溶液里只有部分电离的电解质是弱电解质,弱电解质包括弱酸、弱碱,氢氧化铝是弱碱,所以是弱电解质;HF是弱酸,所以是弱电解质,故答案为:CF;
(4)在水溶液里或熔融状态下都不导电的化合物是非电解质;所以属于非电解质的是液氨,故答案为:H;
(二)(1)二氧化硫能和有色物质反应生成无色物质,所以二氧化硫有漂白性;氯气和水反应生成次氯酸,次氯酸具有强氧化性,能使有色物质褪色,所以若从左端分别通入SO2和Cl2,装置A中观察到的现象相同,都使品红褪色;
二氧化硫和氧气在五氧化二钒作催化剂、加热条件下能发生氧化还原反应生成三氧化硫,反应方程式为 2SO2+O2
2SO3,
故答案为:相同;2SO2+O2
2SO3;
(2)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3,所以X中S和O的原子个数比为
:
=3:2,所以该离子为S2O3 2-;氯气有强氧化性,能和硫代硫酸根离子发生氧化还原反应,根据题意知,该反应中有硫酸根离子生成,所以氯气中氯元素得电子生成氯离子,所以该反应的离子方程式为
4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+,
故答案为:4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+.
(2)由两种或多种物质混合而成的,这些物质相互间没有发生反应,混合物里各物质都保持原来的性质;纯盐酸中氯化氢是溶质,水是溶剂,所以是混合物;氢氧化铁胶体是混合物,所以属于混合物的为CG,故答案为:CG;
(3)在水溶液里只有部分电离的电解质是弱电解质,弱电解质包括弱酸、弱碱,氢氧化铝是弱碱,所以是弱电解质;HF是弱酸,所以是弱电解质,故答案为:CF;
(4)在水溶液里或熔融状态下都不导电的化合物是非电解质;所以属于非电解质的是液氨,故答案为:H;
(二)(1)二氧化硫能和有色物质反应生成无色物质,所以二氧化硫有漂白性;氯气和水反应生成次氯酸,次氯酸具有强氧化性,能使有色物质褪色,所以若从左端分别通入SO2和Cl2,装置A中观察到的现象相同,都使品红褪色;
二氧化硫和氧气在五氧化二钒作催化剂、加热条件下能发生氧化还原反应生成三氧化硫,反应方程式为 2SO2+O2
| ||
| △ |
故答案为:相同;2SO2+O2
| ||
| △ |
(2)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3,所以X中S和O的原子个数比为
| 4 |
| 32 |
| 3 |
| 16 |
4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+,
故答案为:4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+.
点评:本题考查了氧化物、混合物、弱电解质等知识点,难度不大,注意无论电解质还是非电解质都必须首先是化合物,电解质的强弱是根据电离程度区分的,与溶液的导电能力强弱无关.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
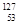 I可用于治疗肿瘤。该核素的质子数为_________,中子数为___________,质量数为______________,核外电子数为__________________。
I可用于治疗肿瘤。该核素的质子数为_________,中子数为___________,质量数为______________,核外电子数为__________________。