网址:http://m.1010jiajiao.com/timu3_id_64807[举报]
A.离子晶体中一定存在离子键,分子晶体中一定存在共价键
B.主族元素形成的单质,从上到下熔沸点逐渐升高
C.N2分子中的共价键是由两个σ键和一个π键组成的
D.以极性键结合的分子不一定是极性分子
II.下列叙述正确的是
A.用VSERP理论预测PCl3的立体构型为平面三角形
B.SO2和CO2都是含有极性键的非极性分子
C.在NH+4和[Cu(NH3)4]2+中都存在配位键
D.铝元素的原子核外共有5种不同运动状态的电子
III.Q、R、X、Y、Z五种元素的原子序数逐渐增大.已知Z的原子序数为29,其余均为短周期主族元素.Y原子的价电子排布为msnmpn.R原子核外L层的电子数为奇数,Q、X原子p轨道的电子数分别为2和4.请回答下列问题:
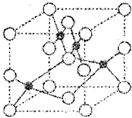
(1)Z2+的核外电子排布式是
(2)Q与Y形成的最简单气态氢化物分别为A、B,试比较它们的热稳定性并说明理由:
(3)Q和X形成的一种化合物甲的相对分子质量为44,则甲的空间构型是
(4)R有多种氧化物,其中乙的相对分子质量最小.在一定条件下,2L的乙气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
(5)这五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH,Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。
回答下列问题
(1)能否用玻璃试剂瓶来盛HF溶液,为什么?用化学方程式加以解释 ;
(2)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(3)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
|
|
实验事实 |
|
事实一 |
水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
|
事实二 |
盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
|
事实三 |
普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
|
事实四 |
在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
|
事实五 |
1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
结论:从实验上说明碱性水溶液条件下,H2O可作 剂;NaOH作 剂,降低反应 。高温无水环境下,NaOH作 剂。
(4)在太阳能电池表面沉积深蓝色减反膜——氮化硅晶膜。常用硅烷(SiH4)与氨气(NH3)在等离子体中反应。硅烷是一种无色、有毒气体,常温下与空气和水剧烈反应。下列关于硅烷、氮化硅的叙述不正确的是 。
A.在使用硅烷时要注意隔离空气和水,SiH4能与水发生氧化还原反应生成H2;
B.硅烷与氨气反应的化学方程式为:3SiH4+4NH3=Si3N4+12H2↑,反应中NH3作氧化剂;
C.它们具有卓越的抗氧化、绝缘性能和隔绝性能,化学稳定性很好,不与任何酸、碱反应;
D.氮化硅晶体中只存在共价键,Si3N4是优良的新型无机非金属材料。
查看习题详情和答案>>
清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH,Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。
回答下列问题
(1)能否用玻璃试剂瓶来盛HF溶液,为什么?用化学方程式加以解释 ;
(2)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(3)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
| | 实验事实 |
| 事实一 | 水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
| 事实二 | 盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
| 事实三 | 普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
| 事实四 | 在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
| 事实五 | 1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
结论:从实验上说明碱性水溶液条件下,H2O可作 剂;NaOH作 剂,降低反应 。高温无水环境下,NaOH作 剂。
(4)在太阳能电池表面沉积深蓝色减反膜——氮化硅晶膜。常用硅烷(SiH4)与氨气(NH3)在等离子体中反应。硅烷是一种无色、有毒气体,常温下与空气和水剧烈反应。下列关于硅烷、氮化硅的叙述不正确的是 。
A.在使用硅烷时要注意隔离空气和水,SiH4能与水发生氧化还原反应生成H2;
B.硅烷与氨气反应的化学方程式为:3SiH4+4NH3=Si3N4+12H2↑,反应中NH3作氧化剂;
C.它们具有卓越的抗氧化、绝缘性能和隔绝性能,化学稳定性很好,不与任何酸、碱反应;
D.氮化硅晶体中只存在共价键,Si3N4是优良的新型无机非金属材料。 查看习题详情和答案>>
回答下列问题
(1)能否用玻璃试剂瓶来盛HF溶液,为什么?用化学方程式加以解释 ;
(2)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(3)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
| | 实验事实 |
| 事实一 | 水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
| 事实二 | 盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
| 事实三 | 普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
| 事实四 | 在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
| 事实五 | 1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
结论:从实验上说明碱性水溶液条件下,H2O可作 剂;NaOH作 剂,降低反应 。高温无水环境下,NaOH作 剂。
(4)在太阳能电池表面沉积深蓝色减反膜——氮化硅晶膜。常用硅烷(SiH4)与氨气(NH3)在等离子体中反应。硅烷是一种无色、有毒气体,常温下与空气和水剧烈反应。下列关于硅烷、氮化硅的叙述不正确的是 。
A.在使用硅烷时要注意隔离空气和水,SiH4能与水发生氧化还原反应生成H2;
B.硅烷与氨气反应的化学方程式为:3SiH4+4NH3=Si3N4+12H2↑,反应中NH3作氧化剂;
C.它们具有卓越的抗氧化、绝缘性能和隔绝性能,化学稳定性很好,不与任何酸、碱反应;
D.氮化硅晶体中只存在共价键,Si3N4是优良的新型无机非金属材料。
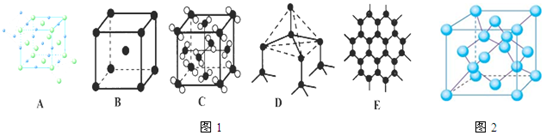
(1)如图1分别代表了五种常见的晶体,分别是:A______,B______,C______,D______,E______.(填名称或化学式)
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是______.
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳的两种常见单质,下列叙述正确的有______.
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b.晶体中共价键的键长:金刚石中C-C<石墨中C-C;
c.晶体的熔点:金刚石>石墨 d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力;
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图2,一个晶胞中的C原子数目为______.
(5)C与孔雀石共热可以得到金属铜,铜原子的原子结构示意图为______,金属铜采用面心立方最密堆积(在晶胞的顶点和面心均含有一个Cu原子),已知Cu单质的晶体密度为ρg/cm3,Cu的相对原子质量为M,阿伏伽德罗常数NA,则Cu的原子半径为______.