网址:http://m.1010jiajiao.com/timu3_id_64440[举报]
如下图装置所示,是用氢氧燃料电池B进行的某电解实验:
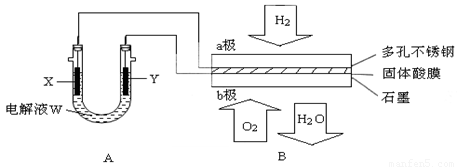
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:
Li2NH+H2=LiNH2+LiH ,则下列说法中正确的是 。
A.Li2NH中N的化合价是-1
B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等
D.此法储氢和钢瓶储氢的原理相同
(2)在电池B工作时:
① 若用固体Ca(HSO4)2为电解质传递H+,则电子由 极流出,H+向 极移动。(填“a”或“b ”)
② b极上的电极反应式为:
③ 外电路中,每转移0.1 mol电子,在a极消耗 L的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
① 电解池中X极上的电极反应式是 。在X极这边观察到的现象是 。
② 检验Y电极上反应产物的方法是 。
③ 若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是 。
查看习题详情和答案>>
(14分)如下图装置所示,是用氢氧燃料电池B进行的某电解实验:
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:Li2NH+H2=LiNH2+LiH,则下列说法中正确的是________。
| A.Li2NH中N的化合价是-1价 | B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+ 和H+的离子半径相等 | D.此法储氢和钢瓶储氢的原理相同 |
①若用固体Ca(HSO4)2为电解质传递H+,则电子由________极流出,H+向________极移动。(填“a”或“b”)
②b极上的电极反应式为:________________________________
③外电路中,每转移0.1 mol电子,在a极消耗________上的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCI溶液,则B工作时:
①电解池中X极上的电极反应式是 ________________________________。
在X极这边观察到的现象是 _____________________________________。
②检验Y电极上反应产物的方法是 _________________________________。
③若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是_____________________。 查看习题详情和答案>>
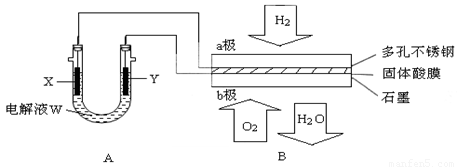
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:Li2NH+H2=LiNH2+LiH,则下列说法中正确的是________。
| A.Li2NH中N的化合价是-1价 | B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+ 和H+的离子半径相等 | D.此法储氢和钢瓶储氢的原理相同 |
①若用固体Ca(HSO4)2为电解质传递H+,则电子由________极流出,H+向________极移动。(填“a”或“b”)
②b极上的电极反应式为:________________________________
③外电路中,每转移0.1 mol电子,在a极消耗________上的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCI溶液,则B工作时:
①电解池中X极上的电极反应式是 ________________________________。
在X极这边观察到的现象是 _____________________________________。
②检验Y电极上反应产物的方法是 _________________________________。
③若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是_____________________。

请回答下列问题:
Ⅰ.(1)仪器p的名称是
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 变红 变红 |
褪色 褪色 |
褪色 | 浅黄色 |
| 体现SO2的性质 | 水溶液显酸性 | 漂白性 | 还原性 还原性 |
氧化性 氧化性 |
写出④中反应的化学方程式:
Ⅱ.若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液.回答下列问题:
(1)p中盛装试剂的化学式为
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在实验过程中,在③处能观察到
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:
用如下装置可以完成一系列实验(图中夹持装置已略去)。
请回答下列问题:
Ⅰ.若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 |
|
| 褪色 | 浅黄色 |
| 体现SO2的性质 |
|
|
|
|
II.若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。回答下列问题:
(1)p中盛装试剂为 。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式 。①处包有的某固体物质可能是 。
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在整个实验过程中,在③处能观察到 。
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式: 。
查看习题详情和答案>>