网址:http://m.1010jiajiao.com/timu3_id_64360[举报]
(1)制备氧化铜![]() 工业CuSO4
工业CuSO4![]() CuSO4溶液
CuSO4溶液![]() CuSO4·5H2O→……→CuO
CuSO4·5H2O→……→CuO
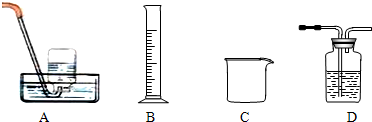
①步骤Ⅰ的目的是除不溶性杂质。操作是______________________________。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热:Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是______________________________。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是,水浴加热烘干。水浴加热的特点是______________。
(2)①取A、B两支试管,往A中加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是_____________________________。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有______________。
查看习题详情和答案>>(1)制备氧化铜
工业CuSO4
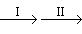 CuSO4溶液
CuSO4溶液 CuSO4·5H2O
CuSO4·5H2O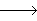 ……
……  CuO
CuO ①步骤Ⅰ的目的是除不溶性杂质。操作是_____________ 。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热:Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。滴加H2O2的目的是__________ ,加入Cu2(OH)2CO2粉末的目的是__________ 。
③步骤Ⅲ的目的是得到CuSO4·5H2O,操作是将CuSO4·5H2O 溶液加热蒸发至有晶膜出现时,停止加热,_____________,水浴加热烘干。 采用水浴加热的原因是________________ 。
(2)探究氧化铜性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡,结论是____________ 。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器除导管、橡皮塞、水槽外还必须有__________ 。
(1)制备氧化铜
工业CuSO4
 CuSO4溶液
CuSO4溶液 CuSO4·5H2O
CuSO4·5H2O ……
……  CuO
CuO ①步骤Ⅰ的目的是除不溶性杂质。操作是_____________ 。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热:Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶夜pH=3.5的原因是___________ 。
③步骤Ⅲ的目的是得到CuSO4·5H2O,操作是____________ ,过滤,水浴加热烘干。水浴加热的特点是______________ 。
(2)探究氧化铜性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡,结论是____________ 。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有______________ 。
氧化铜有多种用途,如作玻璃着色剂,油类脱硫剂等,为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
(1)制备氧化铜
![]()
①步骤Ⅰ的目的是除不溶性杂质.操作是________.
②步骤Ⅱ的目的是除铁.操作是:滴加H2O2溶液,稍加热:Fe2+ 转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1.控制溶液pH=3.5的原因是________.
③步骤Ⅲ的目的是得到CuSO4·5H2O,操作是________,过滤,水浴加热烘干.水浴加热的特点是________.
(2)探究氧化铜的性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡,结论是________.
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有________.
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
工业CuSO4
| Ⅰ |
| Ⅱ |
| Ⅲ |
(1)步骤Ⅰ的操作是加入水和少量硫酸溶解样品并过滤,目的是除去不溶性杂质,这一步骤中加酸的作用是
(2)步骤Ⅱ的操作是:滴加H2O2溶液,稍加热;待反应完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1.
①这一步骤的目的是
②写出加入H2O2溶液时发生反应的离子方程式
③控制溶液pH=3.5的目的是
(3)步骤Ⅲ的目的是得到CuSO4?5H2O晶体,操作是
㈡探究氧化铜性质
(1)取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是
(2)为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器或装置为