网址:http://m.1010jiajiao.com/timu3_id_64312[举报]
(12分)
写出下列反应的化学方程式,并指出该反应属于何种反应类型
(1)丙烯通入溴水使溴水退色
(2) 苯和溴单质在铁粉作催化剂条件下反应
(3)工业上由乙炔制聚氯乙烯
__________ ______________
【解析】考查有机反应方程式的书写和有机反应类型的判断。
查看习题详情和答案>>
(12分)
写出下列反应的化学方程式,并指出该反应属于何种反应类型
(1)丙烯通入溴水使溴水退色
(2) 苯和溴单质在铁粉作催化剂条件下反应
(3)工业上由乙炔制聚氯乙烯
__________ ______________
【解析】考查有机反应方程式的书写和有机反应类型的判断。
查看习题详情和答案>>
(17分)A、 B、C、D为四种元素,A原子的1S轨道为半充满;在元素周期表中,B的电负性最大;C2+的电子排布式和Ar相同;D的原子序数为24。
(1)判断元素:A 、B 、C 、D 。
(2)以上这四种元素中,属于d区的是______________________(填元素符号)。
(3)C在周期表中的位置为________周期________族。
(4)写出CB2的电子式 。
(5)元素D的化合物(DO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素还有__________(填元素符号
②DO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断DO2Cl2是__________(填“极性”或“非极性”)分子。
【解析】考查元素周期表的结构和核外电子的排布规律。1S轨道为半充满的是氢元素,即A是H。电负性最大的就是非金属性最强的,所以B是F。C2+的电子排布式和Ar相同,Ar的原子序数是18,所以C是Ca。原子序数为24的是Cr,则D是Cr。由于Cr最后填入的单质在d轨道上,所以Cr属于d区;CaF2是由离子键形成的离子化合物,其电子式为;因为半充满或全场满是稳定的,所以Cr的最外层电子是1,与之相等的还有K和Cu;CCl4、CS2是非极性分子,根据相似相溶原理可判断DO2Cl2也是非极性分子。
查看习题详情和答案>>
有 A、B、C三种短周期元素。A-离子的电子层结构和氖原子相同;短周期元素中B的金属性最强;C的原子核内质子数是B的次外层电子数的2倍。试推断:
⑴.这三种元素分别是:A______、B______、C______;(用元素符号表示)
⑵. A的氢化物分子的电子式是__________;
⑶.C元素的最高价氧化物与足量NaOH溶液反应的离子方程式为___________。
【解析】考查原子核外电子的排布规律。A-离子的电子层结构和氖原子相同,所以A是F。短周期元素中金属性最强的是钠,则B是Na。 C的原子核内质子数是B的次外层电子数的2倍,所以C是S。HF形成的化学键是极性键,其电子式为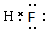 。
。
查看习题详情和答案>>
(17分)A、 B、C、D为四种元素,A原子的1S轨道为半充满;在元素周期表中,B的电负性最大;C2+的电子排布式和Ar相同;D的原子序数为24。
(1)判断元素:A 、B 、C 、D 。
(2)以上这四种元素中,属于d区的是______________________(填元素符号)。
(3)C在周期表中的位置为________周期________族。
(4)写出CB2的电子式 。
(5)元素D的化合物(DO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素还有__________(填元素符号
②DO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断DO2Cl2是__________(填“极性”或“非极性”)分子。
【解析】考查元素周期表的结构和核外电子的排布规律。1S轨道为半充满的是氢元素,即A是H。电负性最大的就是非金属性最强的,所以B是F。C2+的电子排布式和Ar相同,Ar的原子序数是18,所以C是Ca。原子序数为24的是Cr,则D是Cr。由于Cr最后填入的单质在d轨道上,所以Cr属于d区;CaF2是由离子键形成的离子化合物,其电子式为 ;因为半充满或全场满是稳定的,所以Cr的最外层电子是1,与之相等的还有K和Cu;CCl4、CS2是非极性分子,根据相似相溶原理可判断DO2Cl2也是非极性分子。
;因为半充满或全场满是稳定的,所以Cr的最外层电子是1,与之相等的还有K和Cu;CCl4、CS2是非极性分子,根据相似相溶原理可判断DO2Cl2也是非极性分子。
查看习题详情和答案>>