摘要:9.已知反应:C + O2(g) = CO2(g), DH = -393.13kJ×mol-1 2 CO(g) + O2(g) = 2 CO2(g),ΔH = -566 KJ·mol-1 (1)写出石墨与二氧化碳反应的热化学方程式: . 的DS = +175.3J×mol-1×K-1 ①说明此反应的DS为正值的理由: . ②经计算298K时.此反应的DG= (填“> .“= .“< )0 ③此反应在 ℃(填计算式.不必计算出结果)以上.自发方向发生逆转. 10.如图Ⅰ.在恒压密闭容器M中加入2 mol A和2 mol B.起始时容器体积为V L.发生如下反应并达到化学平衡状态:2 Ax C(g),ΔH<0 平衡时A.B.C的物质的量之比为1∶3∶4.C的物质的量为 y mol. ⑴根据题中数据计算.x = .y = , ⑵如图Ⅱ.在体积为V L的恒容密闭容器N中发生上述反应.测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡).平衡时容器中C的物质的量为z mol.由于反应物A.B的状态未知.则z和y的大小也不确定.请在下表中填入A.B的状态与z.y的大小之间的关系: 可能的情形 A.B是否为气态 z与y的大小关系 M(B)与M(C)的大小关系 (M表示摩尔质量) A B ① 是 不是 z = y 无法确定 ② ③ 11.在TK.300MPa时.往容积可变的密闭容器中充入 1molN2.3molH2.此时.容器的体积为200L.向容器中加入催化剂并保持恒温恒压.发生反应:N2 (g)+ 3H2(g) 2NH3(g).达到平衡时 NH3的体积分数为1/3. 试回答下列问题: (1)保持上述温度和压强不变.若向容器中只充入2molNH3.并加入铁触媒催化剂.则平衡时.N2的体积分数是 .容器的体积为 . (2)保持上述温度不变.在200L的定容容器中进行合成氨反应.改变起始时原料气的充入量.一段时间后.测得N2.H2.NH3的物质的量分别为2mol.1mol.2mol.则此时反应N2 (g)+ 3H2(g) 2NH3(g) V(N2)正 3V(H2)逆 (填:“> .“< .“= .“不能确定 ) (3)温度仍保持TK.容器体积保持200L不变.充入amolN2.bmolH2.并加入铁触媒催化剂.反应达到平衡时.NH3的体积分数仍为1/3.体系压强为300MPa.若a:b=1:3.则a= mol. (4)在三个相同容器中各充入1 molN2和3molH2.在某一不同条件下反应并达到平衡.氨的体积分数随时间变化曲线如下图.下列说法正确的是 . A.图Ⅰ可能是不同催化剂对反应的影响.且催化剂性能 2>1 B.图Ⅱ可能是同温同压下.不同催化剂对反应的影响.且催化剂性能1>2 C.图Ⅱ可能是不同压强对反应的影响.且P1>P2 D.图Ⅲ可能是不同温度对反应的影响.且T1>T2
网址:http://m.1010jiajiao.com/timu3_id_63883[举报]
已知A、B、D、H 是中学范围内的常见的单质,J为蓝色溶液.相互转化关系如图所示(部分产物及反应条件已略去),试回答有关问题:
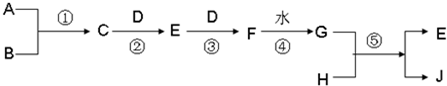
(1)若A为气体,B为固体时,已知反应:C+D→E+H2O,E是一种大气污染物,且将C与E混合可生成淡黄色的B,写出C和E反应的化学方程式:
(2)若A、B均为气体,当将C和G的浓溶液相互接触时会产生白烟,检验白烟中含有的阳离子的方法是:
查看习题详情和答案>>

(1)若A为气体,B为固体时,已知反应:C+D→E+H2O,E是一种大气污染物,且将C与E混合可生成淡黄色的B,写出C和E反应的化学方程式:
2H2S+SO2═3S↓+2H2O
2H2S+SO2═3S↓+2H2O
,其中氧化产物与还原产物的物质的量之比为2:1
2:1
(2)若A、B均为气体,当将C和G的浓溶液相互接触时会产生白烟,检验白烟中含有的阳离子的方法是:
取样,溶于水,加入烧碱共热,用润湿的红色石蕊试纸检验观察到试纸变蓝
取样,溶于水,加入烧碱共热,用润湿的红色石蕊试纸检验观察到试纸变蓝
写出反应②的化学方程式4NH3+5O2
4NO+6H2O
| ||
| 高温高压 |
4NH3+5O2
4NO+6H2O
.
| ||
| 高温高压 |
已知A、B、D、H 是中学范围内的常见的单质,J为蓝色溶液.相互转化关系如图所示(部分产物及反应条件已略去),试回答有关问题:
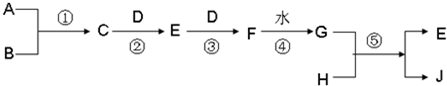
(1)若A为气体,B为固体时,已知反应:C+D→E+H2O,E是一种大气污染物,且将C与E混合可生成淡黄色的B,写出C和E反应的化学方程式:______,其中氧化产物与还原产物的物质的量之比为______
(2)若A、B均为气体,当将C和G的浓溶液相互接触时会产生白烟,检验白烟中含有的阳离子的方法是:______写出反应②的化学方程式______.
查看习题详情和答案>>
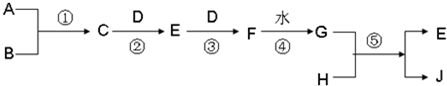
已知A、B、D、H 是中学范围内的常见的单质,J为蓝色溶液.相互转化关系如图所示(部分产物及反应条件已略去),试回答有关问题:
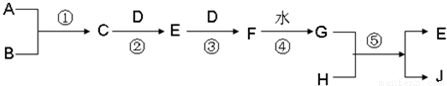
(1)若A为气体,B为固体时,已知反应:C+D→E+H2O,E是一种大气污染物,且将C与E混合可生成淡黄色的B,写出C和E反应的化学方程式:______,其中氧化产物与还原产物的物质的量之比为______
(2)若A、B均为气体,当将C和G的浓溶液相互接触时会产生白烟,检验白烟中含有的阳离子的方法是:______写出反应②的化学方程式______高温高压4NO+6H2O 查看习题详情和答案>>

(1)若A为气体,B为固体时,已知反应:C+D→E+H2O,E是一种大气污染物,且将C与E混合可生成淡黄色的B,写出C和E反应的化学方程式:______,其中氧化产物与还原产物的物质的量之比为______
(2)若A、B均为气体,当将C和G的浓溶液相互接触时会产生白烟,检验白烟中含有的阳离子的方法是:______写出反应②的化学方程式______高温高压4NO+6H2O 查看习题详情和答案>>
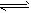 2CO △H>0 ②N2+3H2
2CO △H>0 ②N2+3H2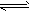 2NH3 △H<0。达平衡后升温,正反应速率的变化是
2NH3 △H<0。达平衡后升温,正反应速率的变化是