摘要:过滤法是将不溶于液体的固体与该液体分离的一种方法.属于混合物的分离方法.
网址:http://m.1010jiajiao.com/timu3_id_6376[举报]
固体酒精因方便、安全而受到野外用餐者的喜爱.其制作主要过程如下:将醋酸钙溶于适量水配制成饱和溶液;向该溶液中慢慢加入酒精,搅匀,即制得固体酒精.
0℃~60℃时,醋酸钙的溶解度随温度的升高而减小(见下表):
(1)将醋酸钙不饱和溶液变为饱和溶液的方法是:加入固体醋酸钙、
(2)10℃时,要配制68g醋酸钙饱和溶液,需无水醋酸钙
(3)利用表中数据确定X值的方法是:
某兴趣小组对上述固体酒精充分燃烧后残留的白色固体的成分进行了如下探究.
【查阅资料】
①醋酸钙[Ca(Ac)2],不可燃,不助燃,易溶于水,溶于水时温度无显著变化;
②醋酸钙受热分解生成碳酸钙和有特殊气味的丙酮.
【猜想与假设】
假设1:白色固体中含有Ca(Ac)2 假设2:白色固体中含有CaCO3
假设3:白色固体中含有CaO 假设4:白色固体中含有Ca(OH)2
【实验探究】
实验①:取少量白色固体溶于足量蒸馏水中,过滤,得到滤液和白色不溶物;
实验②:取①中滤液于试管中,滴入2滴酚酞试液,溶液变为红色;
实验③:取①中滤液于试管中,滴加碳酸钠溶液,有白色沉淀生成.
【交流讨论】
(1)根据实验①,甲同学认为假设2成立,理由是:
(2)根据实验②,乙同学认为假设4成立.丙同学认为假设4不一定成立,但假设3成立,因为丙同学在实验①中还发现:
(3)仅根据实验③,丁同学认为假设3或假设4成立,但戊同学反对,理由是:
(4)欲确认假设1成立,还需进行如下实验:
【反思提高】
写出实验③中有关反应的化学方程式:
查看习题详情和答案>>
0℃~60℃时,醋酸钙的溶解度随温度的升高而减小(见下表):
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 溶解度(g) | 37.4 | 36 | 34.7 | 33.8 | 33.2 | X | 32.7 |
升温
升温
或恒温蒸发浓缩
恒温蒸发浓缩
;(2)10℃时,要配制68g醋酸钙饱和溶液,需无水醋酸钙
18
18
g;(3)利用表中数据确定X值的方法是:
作图,通过描点得到溶解度曲线,找出50℃碳酸钙的溶解度
作图,通过描点得到溶解度曲线,找出50℃碳酸钙的溶解度
.某兴趣小组对上述固体酒精充分燃烧后残留的白色固体的成分进行了如下探究.
【查阅资料】
①醋酸钙[Ca(Ac)2],不可燃,不助燃,易溶于水,溶于水时温度无显著变化;
②醋酸钙受热分解生成碳酸钙和有特殊气味的丙酮.
【猜想与假设】
假设1:白色固体中含有Ca(Ac)2 假设2:白色固体中含有CaCO3
假设3:白色固体中含有CaO 假设4:白色固体中含有Ca(OH)2
【实验探究】
实验①:取少量白色固体溶于足量蒸馏水中,过滤,得到滤液和白色不溶物;
实验②:取①中滤液于试管中,滴入2滴酚酞试液,溶液变为红色;
实验③:取①中滤液于试管中,滴加碳酸钠溶液,有白色沉淀生成.
【交流讨论】
(1)根据实验①,甲同学认为假设2成立,理由是:
碳酸钙不溶于水
碳酸钙不溶于水
;(2)根据实验②,乙同学认为假设4成立.丙同学认为假设4不一定成立,但假设3成立,因为丙同学在实验①中还发现:
溶液温度升高
溶液温度升高
.(3)仅根据实验③,丁同学认为假设3或假设4成立,但戊同学反对,理由是:
Ca(Ac)2溶液也可能与Na2C03溶液反应生成白色沉淀
Ca(Ac)2溶液也可能与Na2C03溶液反应生成白色沉淀
;(4)欲确认假设1成立,还需进行如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
灼烧白色固体 灼烧白色固体 |
有特殊气味 有特殊气味 |
假设1成立 |
写出实验③中有关反应的化学方程式:
Na2C03十Ca(OH)2═2NaOH+CaC03↓
Na2C03十Ca(OH)2═2NaOH+CaC03↓
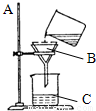
. 过滤是一种净水的方法,利用过滤的方法,可将不溶于水的固体杂质与水分离开来.如图所示是某学生设计的过滤操作示意图.
过滤是一种净水的方法,利用过滤的方法,可将不溶于水的固体杂质与水分离开来.如图所示是某学生设计的过滤操作示意图.
(1)写出有标号仪器的名称:A:______;B:______;C:______.
(2)请指出图中的错误,并加以改正.
| 错误之处 | 改正方法 |
| ______ | ______ |
| ______ | ______ |
| ______ | ______ |
过滤是一种净水的方法,利用过滤的方法,可将不溶于水的固体杂质与水分离开来.如图所示是某学生设计的过滤操作示意图.
(1)写出有标号仪器的名称:A: ;B: ;C: .
(2)请指出图中的错误,并加以改正.
(3)该学生用改正后的装置进行过滤操作,发现过滤后的液体仍有浑浊现象,请你帮他找出造成此现象的可能原因: .
 查看习题详情和答案>>
查看习题详情和答案>>
(1)写出有标号仪器的名称:A: ;B: ;C: .
(2)请指出图中的错误,并加以改正.
| 错误之处 | 改正方法 |
 查看习题详情和答案>>
查看习题详情和答案>>
实验室可用KClO3和MnO2的固体混合物加热制取氧气.现取30.5g的固体混合物加热一段时间收集到一定质量的氧气后,停止反应.
(1)欲求得氧气的质量,将试管中的剩余物冷却到室温后,通过向该试管分多次加水测定剩余物质的办法求得.加水的质量与剩余固体的质量见下表:(MnO2不溶于水)
| 编号 | 1 | 2 | 3 | 4 |
| 加水的质量(g) | 20 | 20 | 20 | 20 |
| 剩余固体的质量(g) | 14.5 | 8.1 | m | 6 |
(2)为了测定固体混合物中MnO2的质量分数,需用______方法回收MnO2.
实验结束后,有3位同学分别展示了所测MnO2的质量分数.
| 小东 | 小南 | 小西 | |
| MnO2% | 35% | 10% | 15% |
①小东:称量KClO3和MnO2固体混合物时将固体放在天平的右边(1g以下用砝码)
②小东:滤液浑浊就干燥
③小东:烧杯里的物质还未充分溶解就开始过滤
④小南:称余下固体时只在天平的左盘垫了张纸
⑤小西:称余下固体前,部分固体洒落地下
(3)若要证明MnO2是该反应的催化剂,还需补做两个实验:①证明MnO2在反应前后化学性质不变.
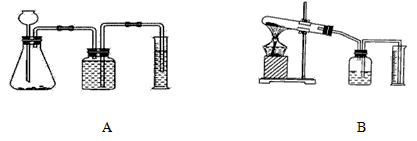
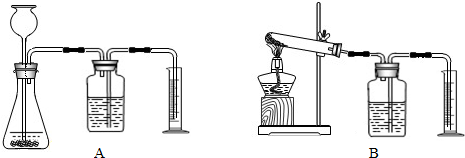
②证明MnO2能改变KClO3反应放出氧气的速率.完成②需选用下图装置中的(填序号)______.要比较产生O2的快慢,除可以直接观察气泡产生的快慢,还可以______.
 查看习题详情和答案>>
查看习题详情和答案>>
实验室可用KClO3和MnO2的固体混合物加热制取氧气。现取30.5g的固体混合物加热一段时间收集到一定质量的氧气后,停止反应。
欲求得氧气的质量,将试管中的剩余物冷却到室温后,通过向该试管分多次加水测定剩余物质的办法求得。加水的质量与剩余固体的质量见下表:(MnO2不溶于水)
欲求得氧气的质量,将试管中的剩余物冷却到室温后,通过向该试管分多次加水测定剩余物质的办法求得。加水的质量与剩余固体的质量见下表:(MnO2不溶于水)
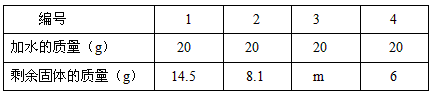
(1)表中m的值为 ,所得氧气的质量为 。
(2)为了测定固体混合物中MnO2的质量分数,需用 方法回收MnO2。
实验结束后,有3位同学分别展示了所测MnO2的质量分数。
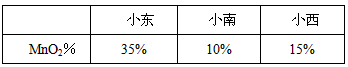
(3)老师的评价是:小东结果偏高,小南、小西结果偏低。于是全班同学讨论误差,下列所找原因正确的是(填序号) 。
①小东:称量KClO3和MnO2固体混合物时将固体放在天平的右边(1g以下用砝码)
②小东:滤液浑浊就干燥
③小东:烧杯里的物质还未充分溶解就开始过滤
④小南:称余下固体时只在天平的左盘垫了张纸
⑤小西:称余下固体前,部分固体洒落地下
①小东:称量KClO3和MnO2固体混合物时将固体放在天平的右边(1g以下用砝码)
②小东:滤液浑浊就干燥
③小东:烧杯里的物质还未充分溶解就开始过滤
④小南:称余下固体时只在天平的左盘垫了张纸
⑤小西:称余下固体前,部分固体洒落地下
(4)若要证明MnO2是该反应的催化剂,还需补做两个实验:
①证明MnO2在反应前后化学性质不变。
②证明MnO2能改变KClO3反应放出氧气的速率。完成②需选用下图装置中的(填序号) 。
要比较产生O2的快慢,除可以直接观察气泡产生的快慢,还可以 。
①证明MnO2在反应前后化学性质不变。
②证明MnO2能改变KClO3反应放出氧气的速率。完成②需选用下图装置中的(填序号) 。
要比较产生O2的快慢,除可以直接观察气泡产生的快慢,还可以 。