摘要:4.[福建漳州双语实验学校09年高考理科综合模拟试卷三化学部分].下列实验操作都能够达到预期目的的是 ①.滴加银氨溶液并加热检验甲酸中有无甲醛 ②.可以采用多次盐析或多次渗析的方法分离.提纯蛋白质 ③.通入澄清石灰水检验SO2 气体中混有CO2 ④.滴入酚酞溶液确定纯碱中有无烧碱 ⑤.用米汤直接检验食用盐中是否含有碘元素 ⑥.往溶液中加入氢氧化钠溶液并加热.生成使湿润红色石蕊试纸变蓝的有刺激性气味气体.证明原溶液含有铵盐 A.①④⑥ B. ②⑤⑥ C. ②⑥ D. ④⑤⑥
网址:http://m.1010jiajiao.com/timu3_id_63629[举报]
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
[实验一]根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸的受热分解产物中含有CO2和CO(部分夹持仪器和加热装置省略)

(1)用字母表示接口的正确连接顺序.
a→b→c→
(2)用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,原因是
(3)利用改进后装置进行的实验时,要先加热
[实验二]探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,溶液褪色总是先慢后快.为探究其原因,同学们做了如下的对比实验:
该对比实验的结论是
查看习题详情和答案>>
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 有毒,具有腐蚀性,易溶于水,二元弱酸. 100℃开始升华,157℃时开始分解. 草酸与浓硫酸混合加热产生CO2、CO和H2O. 草酸钙和草酸氢钙均为白色不溶物 |

(1)用字母表示接口的正确连接顺序.
a→b→c→
f
f
→g
g
→d→e→h
h
→i
i
→b
b
→c
c
→尾气处理(2)用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,原因是
草酸蒸气也可以使澄清石灰水变浑浊,无法确定二氧化碳的存在,
草酸蒸气也可以使澄清石灰水变浑浊,无法确定二氧化碳的存在,
;请你提出改进意见在A前添加一个盛水的洗气瓶,除去草酸蒸气
在A前添加一个盛水的洗气瓶,除去草酸蒸气
.(3)利用改进后装置进行的实验时,要先加热
A
A
装置,(填“A”、“B”、“C”、“D”、“E”,下同)后加热E
E
装置;能证明分解产物中有CO的实验依据是E中黑色氧化铜变红,E后的澄清石灰水变浑浊
E中黑色氧化铜变红,E后的澄清石灰水变浑浊
.[实验二]探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有
还原性
还原性
.(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,溶液褪色总是先慢后快.为探究其原因,同学们做了如下的对比实验:
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(S) (g) |
褪色时间 (S) | ||
| C(mol?L-1) | V(mL) | C(mol?L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
反应生成的Mn2+有催化作用,加快了反应速率
反应生成的Mn2+有催化作用,加快了反应速率
.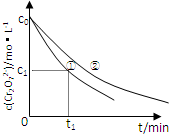 (2013?安徽)某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4?24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(2013?安徽)某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4?24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
| 实验 编号 |
初始 pH |
废水样品 体积/mL |
草酸溶液 体积/mL |
蒸馏水 体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 20 |
20 20 |
(2)上述反应后草酸被氧化为
CO2
CO2
(填化学式).(3)实验①和②的结果表明
溶液pH对该反应的速率有影响
溶液pH对该反应的速率有影响
;实验①中0~t1时间段反应速率v(Cr3+)=| 2(c0-c1) |
| t1 |
| 2(c0-c1) |
| t1 |
(4)该课题组对铁明矾[Al2Fe(SO4)4?24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:
Al3+起催化作用
Al3+起催化作用
;假设三:
SO42-起催化作用
SO42-起催化作用
;(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4?Al2(SO4)3?24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
某实验小组利用稀硫酸与金属铝反应探究影响化学反应速率的因素,得到如下实验数据:
分析上述数据,回答下列问题:
(1)实验1和2表明, 对反应速率有影响.
(2)可表明反应物浓度对反应速率产生影响的是实验 (填实验序号).
(3)本实验中影响反应速率的其他因素还有 .
(4)若进行实验3时在铝片上放一只碳棒,金属消失的时间会远远小于125s.其原因是 .
(5)常温下,为了加快反应速率,有人将实验所用0.8mol?L-1 H2SO4换成18.4mol?L-1 H2SO4,你认为 (填“可以”或“不可以”),因为 .
查看习题详情和答案>>
| 实验 序号 |
铝的 质量/g |
铝的 形态 |
c(H2SO4) /mol?L-1 |
V(H2SO4) /mL |
溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 铝片 | 0.8 | 50 | 20 | 35 | 200 |
| 2 | 0.10 | 铝粉 | 0.8 | 50 | 20 | 36 | 25 |
| 3 | 0.10 | 铝片 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 铝片 | 1.0 | 50 | 35 | 50 | 50 |
(1)实验1和2表明,
(2)可表明反应物浓度对反应速率产生影响的是实验
(3)本实验中影响反应速率的其他因素还有
(4)若进行实验3时在铝片上放一只碳棒,金属消失的时间会远远小于125s.其原因是
(5)常温下,为了加快反应速率,有人将实验所用0.8mol?L-1 H2SO4换成18.4mol?L-1 H2SO4,你认为
(一)实验需要0.1mol/LNaOH溶液450ml,根据溶液配制中情况回答下列问题:
(1)根据计算得知,所需NaOH的质量为
(2)配制一定物质的量浓度溶液的实验中,如果出现以下操作:
A.称量用了生锈的砝码; B.将NaOH放在纸张上称量;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D.往容量瓶转移时,有少量液体溅出 E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线 G.、容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)
偏大的有
(二)某学生用质量分数为98%、密度为1.84g/cm3的浓硫酸,配制0.2mol/L的硫酸溶液500mL.
试回答下列问题:
(1)计算所需浓硫酸的体积
(2)从下列用品中选出实验所需要的仪器
A.1000mL烧杯 B.100mL烧杯 C.10mL量筒
D.100mL量筒 E.500mL容量瓶 F.1000mL容量瓶
G.广口瓶 H.托盘天平 I.玻璃棒
除选用上述仪器外,尚缺少的必要仪器或用品是
(3)该学生根据计算结果,进行如下实验操作:①用量筒量取计算所需体积的浓硫酸;②向量筒中加入少量蒸馏水,并用玻璃棒搅拌;③立即将稀释后的溶液转入容量瓶中;
④然后直接将蒸馏水注入容量瓶直至刻度线;⑤把容量瓶盖盖紧,再振荡摇匀.你认为上述实验中错误的操作是
查看习题详情和答案>>
(1)根据计算得知,所需NaOH的质量为
2.0
2.0
g.(2)配制一定物质的量浓度溶液的实验中,如果出现以下操作:
A.称量用了生锈的砝码; B.将NaOH放在纸张上称量;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D.往容量瓶转移时,有少量液体溅出 E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线 G.、容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)
偏大的有
AC
AC
.(二)某学生用质量分数为98%、密度为1.84g/cm3的浓硫酸,配制0.2mol/L的硫酸溶液500mL.
试回答下列问题:
(1)计算所需浓硫酸的体积
5.4mL
5.4mL
(计算结果保留到小数点后1位).(2)从下列用品中选出实验所需要的仪器
BCEI
BCEI
(填序号).A.1000mL烧杯 B.100mL烧杯 C.10mL量筒
D.100mL量筒 E.500mL容量瓶 F.1000mL容量瓶
G.广口瓶 H.托盘天平 I.玻璃棒
除选用上述仪器外,尚缺少的必要仪器或用品是
胶头滴管
胶头滴管
.(3)该学生根据计算结果,进行如下实验操作:①用量筒量取计算所需体积的浓硫酸;②向量筒中加入少量蒸馏水,并用玻璃棒搅拌;③立即将稀释后的溶液转入容量瓶中;
④然后直接将蒸馏水注入容量瓶直至刻度线;⑤把容量瓶盖盖紧,再振荡摇匀.你认为上述实验中错误的操作是
②③④
②③④
(用编号表示).实验需要0.1mol/L NaOH溶液450mL,根据溶液配制中的情况回答下列问题:实验操作如下:
(1)请在下列操作步骤中填写有关的空格:
①用托盘天平称取
②加水溶解,冷却后将溶液沿玻璃棒注入
③用少量蒸馏水洗涤烧杯2-3次,并将洗涤液也全部转移到容量瓶中;
④继续向容量瓶中加蒸馏水,直到液面接近刻度线
⑤改用
⑥盖好容量瓶塞,反复颠倒,摇匀;
⑦将配好的溶液倒入试剂瓶中,贴好标签.
(2)配制过程中,下列情况会使配制结果偏高的是
①定容时俯视刻度线观察液面; ②容量瓶使用时未干燥;
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线;
④移液后未洗涤烧杯和玻璃棒.
查看习题详情和答案>>
(1)请在下列操作步骤中填写有关的空格:
①用托盘天平称取
2.0
2.0
g氢氧化钠固体;②加水溶解,冷却后将溶液沿玻璃棒注入
500ml容量瓶
500ml容量瓶
;③用少量蒸馏水洗涤烧杯2-3次,并将洗涤液也全部转移到容量瓶中;
④继续向容量瓶中加蒸馏水,直到液面接近刻度线
1~2
1~2
cm处;⑤改用
胶头滴管
胶头滴管
逐滴加蒸馏水,使溶液凹面恰好与刻度相切;⑥盖好容量瓶塞,反复颠倒,摇匀;
⑦将配好的溶液倒入试剂瓶中,贴好标签.
(2)配制过程中,下列情况会使配制结果偏高的是
①
①
(填序号)①定容时俯视刻度线观察液面; ②容量瓶使用时未干燥;
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线;
④移液后未洗涤烧杯和玻璃棒.