网址:http://m.1010jiajiao.com/timu3_id_63611[举报]
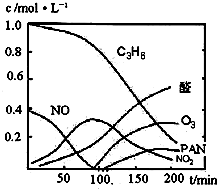
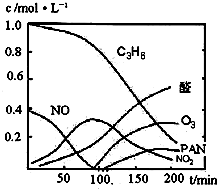 汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线.结合曲线,试回答下列问题.
汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线.结合曲线,试回答下列问题.(1)该烟雾箱实验可模拟下列哪种二次污染产生的机理
(a)臭氧层破损坏 (b)光化学烟雾
(c)酸雨的形成 (d)白色污染
(2)0~100min内,平均反应速率最大的是:
(3)已知:
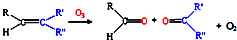 ,写出丙烯与臭氧作用生成醛的化学方程式(并配平)
,写出丙烯与臭氧作用生成醛的化学方程式(并配平)(4)消除汽车尾气污染,喷NH3选择性催化还原是常用的一种方法.在950℃时喷NH3与NO反应而脱氮生成氮气,该反应的化学方程式为:
| ||
| ||
(5)2000K时,可以发生如下反应:
1/2N2+1/2O2?NO,K1
1/2N2+O2?NO2,K2
4NO?2NO2+N2,该反应的平衡常数K3=
| K22 |
| K14 |
| K22 |
| K14 |
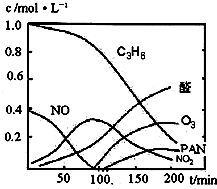 汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线.结合曲线,试回答下列问题.
汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线.结合曲线,试回答下列问题.
(1)该烟雾箱实验可模拟下列哪种二次污染产生的机理______.
(a)臭氧层破损坏 (b)光化学烟雾
(c)酸雨的形成 (d)白色污染
(2)0~100min内,平均反应速率最大的是:______(选填:C3H6、NO、NO2、醛、O3、PAN)
(3)已知: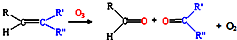 ,写出丙烯与臭氧作用生成醛的化学方程式(并配平)______.
,写出丙烯与臭氧作用生成醛的化学方程式(并配平)______.
(4)消除汽车尾气污染,喷NH3选择性催化还原是常用的一种方法.在950℃时喷NH3与NO反应而脱氮生成氮气,该反应的化学方程式为:______.
(5)2000K时,可以发生如下反应:
1/2N2+1/2O2?NO,K1
1/2N2+O2?NO2,K2
4NO?2NO2+N2,该反应的平衡常数K3=______(用K1、K2表示).
查看习题详情和答案>>
(1)该烟雾箱实验可模拟下列哪种二次污染产生的机理______.
(a)臭氧层破损坏 (b)光化学烟雾
(c)酸雨的形成 (d)白色污染
(2)0~100min内,平均反应速率最大的是:______(选填:C3H6、NO、NO2、醛、O3、PAN)
(3)已知:
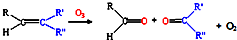
,写出丙烯与臭氧作用生成醛的化学方程式(并配平)______.
(4)消除汽车尾气污染,喷NH3选择性催化还原是常用的一种方法.在950℃时喷NH3与NO反应而脱氮生成氮气,该反应的化学方程式为:______.
(5)2000K时,可以发生如下反应:
1/2N2+1/2O2?NO,K1
1/2N2+O2?NO2,K2
4NO?2NO2+N2,该反应的平衡常数K3=______(用K1、K2表示).
(1)该烟雾箱实验可模拟下列哪种二次污染产生的机理______.
(a)臭氧层破损坏 (b)光化学烟雾
(c)酸雨的形成 (d)白色污染
(2)0~100min内,平均反应速率最大的是:______(选填:C3H6、NO、NO2、醛、O3、PAN)
(3)已知:
 ,写出丙烯与臭氧作用生成醛的化学方程式(并配平)______.
,写出丙烯与臭氧作用生成醛的化学方程式(并配平)______.(4)消除汽车尾气污染,喷NH3选择性催化还原是常用的一种方法.在950℃时喷NH3与NO反应而脱氮生成氮气,该反应的化学方程式为:______ 5N2+6H2O
 查看习题详情和答案>>
查看习题详情和答案>>
(14分)能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ ·mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ ·mol-1
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。

下列说法中正确的是_____________(填字母序号)。
A.负极的电极反应式为:CO + O2-―2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移
D.传感器中通过的电流越大,尾气中CO的含量越高
(3)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
| 物 质 | CO | H2 | CH3OH |
| 浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
① 该反应的平衡常数表达式为:K=_____________________。
② 该时间内反应速率v(H2)=_________________。
③ 平衡时CO的转化率为_________________(保留1位小数)。
查看习题详情和答案>>