摘要:10.在25℃时.pH等于3的 溶液中水的电离度为 .pH等于11的 溶液中水的电离度为 .则 与 的叙述正确的是( ) A. B. C. D.不一定
网址:http://m.1010jiajiao.com/timu3_id_62689[举报]
与水的离子积常数相似,弱电解质在水溶液中电离出来的阴、阳离子的物质的量浓度之积与未电离的电解质的物质的量浓度之商,在一定温度下也是一个常数。例如,CH3COOH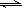 CH3COO-+H+,在25℃时,K=
CH3COO-+H+,在25℃时,K=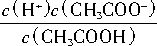 =1.8×10-5。若CH3COOH在电离平衡时的浓度近似等于其起始浓度,则在25℃时,0.2mol/LCH3COOH溶液的pH约为(已知:lg2=0.30,lg3=0.5) ( )。
=1.8×10-5。若CH3COOH在电离平衡时的浓度近似等于其起始浓度,则在25℃时,0.2mol/LCH3COOH溶液的pH约为(已知:lg2=0.30,lg3=0.5) ( )。
A.2.0 B.2.3 C.4.7 D.2.7 查看习题详情和答案>>
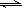 CH3COO-+H+,在25℃时,K=
CH3COO-+H+,在25℃时,K=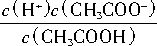 =1.8×10-5。若CH3COOH在电离平衡时的浓度近似等于其起始浓度,则在25℃时,0.2mol/LCH3COOH溶液的pH约为(已知:lg2=0.30,lg3=0.5) ( )。
=1.8×10-5。若CH3COOH在电离平衡时的浓度近似等于其起始浓度,则在25℃时,0.2mol/LCH3COOH溶液的pH约为(已知:lg2=0.30,lg3=0.5) ( )。A.2.0 B.2.3 C.4.7 D.2.7 查看习题详情和答案>>
已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
|
查看习题详情和答案>>
已知25℃时有关弱酸的电离平衡常数:
|
查看习题详情和答案>>
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0_5 | 4.9×l0_10 | K1=4.3×l0_7 K2=5.6×l0_11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L—1 HCN溶液与b mol·L—1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
查看习题详情和答案>>已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-) 查看习题详情和答案>>