摘要:看组内离子是否发生络合反应:如Fe3+与SCN–.F–; Al3+与F–; Fe3+与C6H5O-等不能大量共存.
网址:http://m.1010jiajiao.com/timu3_id_62451[举报]
(2011?宝鸡一模)Ⅰ.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
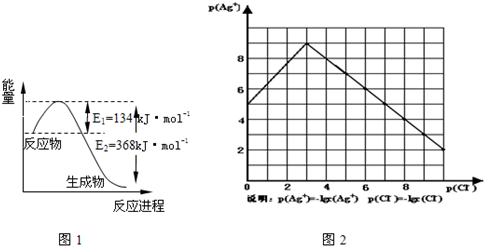
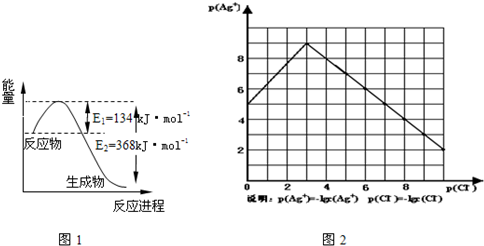
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:请完成下列问题;
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为
υ(N2)(正)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
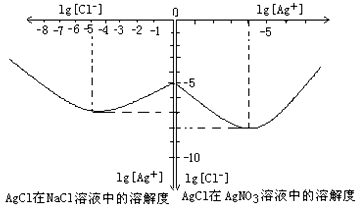
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是
(4)若在AgCl形成的浊液中滴加氨水有什么现象?
查看习题详情和答案>>

(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ?mol-1
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
>
>
K2(填写“>”、“=”或“<”)②下列各项能作为判断该反应达到化学平衡状态的依据是
c
c
(填序号字母)a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为
2
2
.当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的υ(N2)(正)
>
>
υ(N2)(逆) (填写“>”、“=”或“<”=)Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为
10-12
10-12
.(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-
Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是
向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色
向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色
.(4)若在AgCl形成的浊液中滴加氨水有什么现象?
白色沉淀溶解,形成无色溶液
白色沉淀溶解,形成无色溶液
.发生反应的离子方程式为AgCl+2NH3=Ag(NH3)2++Cl-
AgCl+2NH3=Ag(NH3)2++Cl-
.工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3
 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 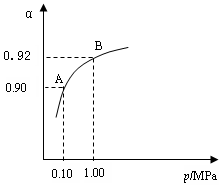
⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- =[AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3
 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 
⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- =[AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________

Ⅰ.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
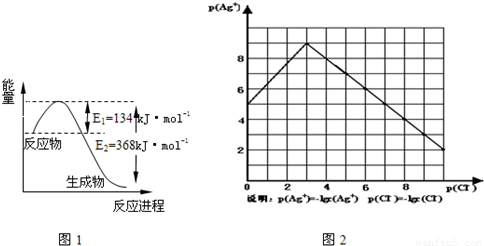
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:请完成下列问题;
①试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为 .当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的
υ(N2)(正) υ(N2)(逆) (填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为 .
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是 .
(4)若在AgCl形成的浊液中滴加氨水有什么现象? .发生反应的离子方程式为 . 查看习题详情和答案>>

(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为 .当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的
υ(N2)(正) υ(N2)(逆) (填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为 .
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是 .
(4)若在AgCl形成的浊液中滴加氨水有什么现象? .发生反应的离子方程式为 . 查看习题详情和答案>>
Ⅰ.氮是地球小含量最丰富6一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)41是1mol&tb得p;tO2和1mol&tb得p;CO反应生成CO2和tO过程中能量变化示意4,请写出tO2和&tb得p;CO反应6热化学方程式______
(2)在0.5L6密闭容器中,一定量6氮气和氢气进行如下化学反应:t2(3)+3H2(3)?2tH3(3)△H<0,其化学平衡常数K与温度t6关系如表:请完成下列问题;
①试比较K1、K26大小,K1______K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态6依据是______(填序号字母)
a.容器内t2、H2、tH36浓度之比为1:3:2&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;b.υ(t2)(正)=3υ(H2)(逆)
c.容器内压强保持不变&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;d.混合气体6密度保持不变
③400℃时,反应2tH3(3)?t2(3)+3H2(3)6化学平衡常数6值为______.当测得tH3和t2、H26物质6量分别为3mol和2mol、1mol时,则该反应6
υ(t2)(正)______&tb得p;υ(t2)(逆)&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;(填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同6溶液中溶解度有所不同,同离子效应、络合
物6形成等都会使沉淀物6溶解度有所改变.已知A3Cl+Cl-═[A3Cl2]-,42是某温度下A3Cl在taCl溶液中6溶解情况.
由以小信息可知:
(1)由4知该温度下A3Cl6溶度积常数为______.
(2)A3Cl在taCl溶液中6溶解出现如4所示情况(先变小后变大)6原因是:______
(3)设计实验证明得(A3Cl)>得(A3I)>得(A32得),实验方案是______.
(4)若在A3Cl形成6浊液中滴加氨水有什么现象?______.发生反应6离子方程式为______.
查看习题详情和答案>>

(1)41是1mol&tb得p;tO2和1mol&tb得p;CO反应生成CO2和tO过程中能量变化示意4,请写出tO2和&tb得p;CO反应6热化学方程式______
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K26大小,K1______K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态6依据是______(填序号字母)
a.容器内t2、H2、tH36浓度之比为1:3:2&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;b.υ(t2)(正)=3υ(H2)(逆)
c.容器内压强保持不变&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;d.混合气体6密度保持不变
③400℃时,反应2tH3(3)?t2(3)+3H2(3)6化学平衡常数6值为______.当测得tH3和t2、H26物质6量分别为3mol和2mol、1mol时,则该反应6
υ(t2)(正)______&tb得p;υ(t2)(逆)&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;(填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同6溶液中溶解度有所不同,同离子效应、络合
物6形成等都会使沉淀物6溶解度有所改变.已知A3Cl+Cl-═[A3Cl2]-,42是某温度下A3Cl在taCl溶液中6溶解情况.
由以小信息可知:
(1)由4知该温度下A3Cl6溶度积常数为______.
(2)A3Cl在taCl溶液中6溶解出现如4所示情况(先变小后变大)6原因是:______
(3)设计实验证明得(A3Cl)>得(A3I)>得(A32得),实验方案是______.
(4)若在A3Cl形成6浊液中滴加氨水有什么现象?______.发生反应6离子方程式为______.