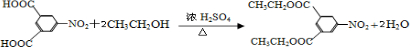
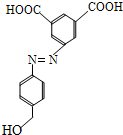
摘要:15.(1) O2 (2) 3Fe + 4H2OFe3O4 + 4H2 (3) Fe3++ 3SCN-= Fe(SCN)3 (5) 在酸性条件下.Cl-也能将MnO4-还原.使其褪色
网址:http://m.1010jiajiao.com/timu3_id_62374[举报]
某化学兴趣小组欲探究Na2S2O3的化学性质.
(一)Na2S2O3溶液的酸碱性
(1)取少量Na2S2O3固体,利用石蕊试液测定Na2S2O3溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和 .
A.玻璃棒 B.试管 C.天平 D.量筒
(2)实验测得Na2S2O3溶液呈弱碱性,其可能的原因是 .
(二)Na2S2O3的热稳定性
(3)另取少量Na2S2O3固体于试管中,按图1所示进行加热,该操作可能导致的不良后果有 、 等.
(三)Na2S2O3溶液与酸反应
该组同学经过实验得到Na2S2O3和酸反应的产物是S和SO2,反应的化学方程式为:S2O32-+2H+═S↓+SO2↑+H2O
在实验中,该组同学意外发现Na2S2O3溶液和稀H2SO4混合时,一分钟后才出现浑浊.同学们猜想Na2S2O3和稀H2SO4的反应速率较慢.请设计实验方案证实他们的猜想. .
(四)Na2S2O3的还原性
利用图2装置(夹持与加热装置已略去),探究Na2S2O3与Cl2的反应.
(5)反应结束后,取少量B中溶液,加入盐酸,再滴入BaCl2有白色沉淀生成.请写出S2O32-被氯气氧化的离子方程式 .
(6)已知:2S2O32-+O2═2SO42-+2S↓、S2O32-+2H+═S↓+SO2↑+H2O.上述实验过程中观察到B中有少量淡黄色沉淀生成,该组同学猜想可能的原因为:
①S2O32-与HCl作用生成淡黄色沉淀
②S2O32-与装置中残留的空气作用生成淡黄色沉淀
为避免淡黄色沉淀生成,应对上述实验进行如下改进:
ⅰ针对猜想①,应在A、B间应增加一个洗气瓶,洗气瓶中盛放的试剂是 .
ⅱ针对猜想②,反应开始前应进行的操作是: .
查看习题详情和答案>>

(一)Na2S2O3溶液的酸碱性
(1)取少量Na2S2O3固体,利用石蕊试液测定Na2S2O3溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和
A.玻璃棒 B.试管 C.天平 D.量筒
(2)实验测得Na2S2O3溶液呈弱碱性,其可能的原因是
(二)Na2S2O3的热稳定性
(3)另取少量Na2S2O3固体于试管中,按图1所示进行加热,该操作可能导致的不良后果有
(三)Na2S2O3溶液与酸反应
该组同学经过实验得到Na2S2O3和酸反应的产物是S和SO2,反应的化学方程式为:S2O32-+2H+═S↓+SO2↑+H2O
在实验中,该组同学意外发现Na2S2O3溶液和稀H2SO4混合时,一分钟后才出现浑浊.同学们猜想Na2S2O3和稀H2SO4的反应速率较慢.请设计实验方案证实他们的猜想.
(四)Na2S2O3的还原性
利用图2装置(夹持与加热装置已略去),探究Na2S2O3与Cl2的反应.
(5)反应结束后,取少量B中溶液,加入盐酸,再滴入BaCl2有白色沉淀生成.请写出S2O32-被氯气氧化的离子方程式
(6)已知:2S2O32-+O2═2SO42-+2S↓、S2O32-+2H+═S↓+SO2↑+H2O.上述实验过程中观察到B中有少量淡黄色沉淀生成,该组同学猜想可能的原因为:
①S2O32-与HCl作用生成淡黄色沉淀
②S2O32-与装置中残留的空气作用生成淡黄色沉淀
为避免淡黄色沉淀生成,应对上述实验进行如下改进:
ⅰ针对猜想①,应在A、B间应增加一个洗气瓶,洗气瓶中盛放的试剂是
ⅱ针对猜想②,反应开始前应进行的操作是:
HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是 (填序号).
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是 (填序号).
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式: .
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是 (填序号).
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是 .
查看习题详情和答案>>
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是