题目内容
某化学兴趣小组欲探究Na2S2O3的化学性质.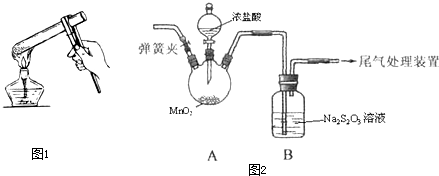
(一)Na2S2O3溶液的酸碱性
(1)取少量Na2S2O3固体,利用石蕊试液测定Na2S2O3溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和 .
A.玻璃棒 B.试管 C.天平 D.量筒
(2)实验测得Na2S2O3溶液呈弱碱性,其可能的原因是 .
(二)Na2S2O3的热稳定性
(3)另取少量Na2S2O3固体于试管中,按图1所示进行加热,该操作可能导致的不良后果有 、 等.
(三)Na2S2O3溶液与酸反应
该组同学经过实验得到Na2S2O3和酸反应的产物是S和SO2,反应的化学方程式为:S2O32-+2H+═S↓+SO2↑+H2O
在实验中,该组同学意外发现Na2S2O3溶液和稀H2SO4混合时,一分钟后才出现浑浊.同学们猜想Na2S2O3和稀H2SO4的反应速率较慢.请设计实验方案证实他们的猜想. .
(四)Na2S2O3的还原性
利用图2装置(夹持与加热装置已略去),探究Na2S2O3与Cl2的反应.
(5)反应结束后,取少量B中溶液,加入盐酸,再滴入BaCl2有白色沉淀生成.请写出S2O32-被氯气氧化的离子方程式 .
(6)已知:2S2O32-+O2═2SO42-+2S↓、S2O32-+2H+═S↓+SO2↑+H2O.上述实验过程中观察到B中有少量淡黄色沉淀生成,该组同学猜想可能的原因为:
①S2O32-与HCl作用生成淡黄色沉淀
②S2O32-与装置中残留的空气作用生成淡黄色沉淀
为避免淡黄色沉淀生成,应对上述实验进行如下改进:
ⅰ针对猜想①,应在A、B间应增加一个洗气瓶,洗气瓶中盛放的试剂是 .
ⅱ针对猜想②,反应开始前应进行的操作是: .

(一)Na2S2O3溶液的酸碱性
(1)取少量Na2S2O3固体,利用石蕊试液测定Na2S2O3溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和
A.玻璃棒 B.试管 C.天平 D.量筒
(2)实验测得Na2S2O3溶液呈弱碱性,其可能的原因是
(二)Na2S2O3的热稳定性
(3)另取少量Na2S2O3固体于试管中,按图1所示进行加热,该操作可能导致的不良后果有
(三)Na2S2O3溶液与酸反应
该组同学经过实验得到Na2S2O3和酸反应的产物是S和SO2,反应的化学方程式为:S2O32-+2H+═S↓+SO2↑+H2O
在实验中,该组同学意外发现Na2S2O3溶液和稀H2SO4混合时,一分钟后才出现浑浊.同学们猜想Na2S2O3和稀H2SO4的反应速率较慢.请设计实验方案证实他们的猜想.
(四)Na2S2O3的还原性
利用图2装置(夹持与加热装置已略去),探究Na2S2O3与Cl2的反应.
(5)反应结束后,取少量B中溶液,加入盐酸,再滴入BaCl2有白色沉淀生成.请写出S2O32-被氯气氧化的离子方程式
(6)已知:2S2O32-+O2═2SO42-+2S↓、S2O32-+2H+═S↓+SO2↑+H2O.上述实验过程中观察到B中有少量淡黄色沉淀生成,该组同学猜想可能的原因为:
①S2O32-与HCl作用生成淡黄色沉淀
②S2O32-与装置中残留的空气作用生成淡黄色沉淀
为避免淡黄色沉淀生成,应对上述实验进行如下改进:
ⅰ针对猜想①,应在A、B间应增加一个洗气瓶,洗气瓶中盛放的试剂是
ⅱ针对猜想②,反应开始前应进行的操作是:
分析:(1)依据实验基本操作分析,取溶液少许与试管中,滴入石蕊试液检验;
(2)依据盐类水解分析判断;
(3)依据实验基本操作可知利用试管给固体加热需要试管口略向下倾斜,试管夹应夹在离试管口三分之一处,手握长柄分析;
(4)设计实验方案证实Na2S2O3和稀H2SO4的反应速率较慢,可以利用同体积、同浓度溶液反应,改变反应的温度设计对比试验,设计验证;
(5)加入盐酸,再滴入BaCl2有白色沉淀生成说明生成硫酸根离子,硫代硫酸根离子被氧化为硫酸根离子,依据电荷守恒和原子守恒书写离子方程式.
(2)依据盐类水解分析判断;
(3)依据实验基本操作可知利用试管给固体加热需要试管口略向下倾斜,试管夹应夹在离试管口三分之一处,手握长柄分析;
(4)设计实验方案证实Na2S2O3和稀H2SO4的反应速率较慢,可以利用同体积、同浓度溶液反应,改变反应的温度设计对比试验,设计验证;
(5)加入盐酸,再滴入BaCl2有白色沉淀生成说明生成硫酸根离子,硫代硫酸根离子被氧化为硫酸根离子,依据电荷守恒和原子守恒书写离子方程式.
解答:解:(1)取药匙取少量Na2S2O3固体与试管中溶解,用胶头滴管滴入石蕊试液测定Na2S2O3溶液的酸碱性,必须选用的仪器有胶头滴管、药匙、试管,
故答案为:B;
(2)Na2S2O3溶液呈弱碱性,是因为硫代硫酸根离子水解的原因,故答案为:S2O32-离子水解呈碱性
(3)试管给固体加热需要试管口略向下倾斜,试管夹应夹在离试管口三分之一处,手应握住试管夹的长柄,装置图中试管口向上,生成的水回流炸裂试管,手握短柄易使试管脱落,故答案为:试管破裂;试管脱落;
(4)Na2S2O3和稀H2SO4的反应速率较慢,可以利用同体积、同浓度溶液反应,改变反应的温度设计对比试验,取与上述实验同浓度同体积的Na2S2O3稀溶液和稀H2SO4于试管中,加热,与前一实验对比,观察很快出现浑浊;
故答案为:取与上述实验同浓度同体积的Na2S2O3稀溶液和稀H2SO4于试管中,加热,与前一实验对比,观察很快出现浑浊;
(5)加入盐酸,再滴入BaCl2有白色沉淀生成,硫代硫酸根离子被氧化为硫酸根离子,S2O32-被氯气氧化的离子方程式为:S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+;
故答案为:S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+;
(6)ⅰ.S2O32-与HCl作用生成淡黄色沉淀,需要把氯气中的氯化氢用饱和食盐水除去,所以AB间增加盛饱和食盐水的洗气装置,故答案为:饱和食盐水;
ⅱ.S2O32-与装置中残留的空气作用生成淡黄色沉淀,需要排净装置中的空气,打开弹簧夹,排尽装置中的空气后关闭弹簧夹,再打开分液漏斗活塞,
故答案为:打开弹簧夹,排尽装置中的空气后关闭弹簧夹,再打开分液漏斗活塞.
故答案为:B;
(2)Na2S2O3溶液呈弱碱性,是因为硫代硫酸根离子水解的原因,故答案为:S2O32-离子水解呈碱性
(3)试管给固体加热需要试管口略向下倾斜,试管夹应夹在离试管口三分之一处,手应握住试管夹的长柄,装置图中试管口向上,生成的水回流炸裂试管,手握短柄易使试管脱落,故答案为:试管破裂;试管脱落;
(4)Na2S2O3和稀H2SO4的反应速率较慢,可以利用同体积、同浓度溶液反应,改变反应的温度设计对比试验,取与上述实验同浓度同体积的Na2S2O3稀溶液和稀H2SO4于试管中,加热,与前一实验对比,观察很快出现浑浊;
故答案为:取与上述实验同浓度同体积的Na2S2O3稀溶液和稀H2SO4于试管中,加热,与前一实验对比,观察很快出现浑浊;
(5)加入盐酸,再滴入BaCl2有白色沉淀生成,硫代硫酸根离子被氧化为硫酸根离子,S2O32-被氯气氧化的离子方程式为:S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+;
故答案为:S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+;
(6)ⅰ.S2O32-与HCl作用生成淡黄色沉淀,需要把氯气中的氯化氢用饱和食盐水除去,所以AB间增加盛饱和食盐水的洗气装置,故答案为:饱和食盐水;
ⅱ.S2O32-与装置中残留的空气作用生成淡黄色沉淀,需要排净装置中的空气,打开弹簧夹,排尽装置中的空气后关闭弹簧夹,再打开分液漏斗活塞,
故答案为:打开弹簧夹,排尽装置中的空气后关闭弹簧夹,再打开分液漏斗活塞.
点评:本题考查了物质性质的实验设计和性质验证,实验基本操作的熟练掌握是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目