摘要:42.钠在空气中燃烧:火焰呈黄色.生成淡黄色物质.
网址:http://m.1010jiajiao.com/timu3_id_61999[举报]
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C,B和酸性气体D 反应能生成C,A和B都能与水生成E,E和D也能生成C.回答下列问题.
(1)填写下列表格:A和水反应生成E(加有酚酞)
(2)写出下列反应的化学方程式:
①B和D生成C:
②Cl2与E的水溶液反应:
查看习题详情和答案>>
(1)填写下列表格:A和水反应生成E(加有酚酞)
| 现象 | 分析(原因) |
钠浮在水面上 钠浮在水面上 |
钠密度小于水 钠密度小于水 |
钠熔成闪亮的小球 钠熔成闪亮的小球 |
钠的熔点低,钠和水反应放热 钠的熔点低,钠和水反应放热 |
小球在水面上四处游动,并发出咝咝声 小球在水面上四处游动,并发出咝咝声 |
钠立即与水剧烈反应,并有氢气产生,同时H2燃烧时产生发出的爆鸣声 钠立即与水剧烈反应,并有氢气产生,同时H2燃烧时产生发出的爆鸣声 |
溶液变红色 溶液变红色 |
反应后溶液生成氢氧化钠,溶液呈碱性,酚酞试液遇碱变红色 反应后溶液生成氢氧化钠,溶液呈碱性,酚酞试液遇碱变红色 |
①B和D生成C:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2CO2═2Na2CO3+O2
②Cl2与E的水溶液反应:
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.将一小块金属钠放在燃烧匙里加热,对其实验现象有如下描述:
①钠在燃烧之前先熔化
②在空气中燃烧有黄色火花四射
③燃烧后得到白色固体
④燃烧时火焰呈黄色
⑤燃烧后生成物为淡黄色固体
其中正确的是
- A.只有⑤
- B.只有①
- C.①④⑤
- D.②③
将一小块金属钠放在燃烧匙里加热,对其实验现象有如下描述:①钠在燃烧之前先熔化②在空气中燃烧有黄色火花四射 ③燃烧后得到白色固体 ④燃烧时火焰呈黄色 ⑤燃烧后生成物为淡黄色固体
其中正确的是( )
A.只有⑤ B.只有① C.①④⑤ D.②③
查看习题详情和答案>>|
将一小块金属钠放在燃烧匙里加热,对其实验现象有如下描述:①钠在燃烧之前先熔化 ②在空气中燃烧有黄色火花四射 ③燃烧后得到白色固体 ④燃烧时火焰呈黄色 ⑤燃烧后生成物为淡黄色固体 其中正确的是 | |
| [ ] | |
A. |
只有⑤ |
B. |
只有① |
C. |
①④⑤ |
D. |
②③ |
(2013?海淀区二模)硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示.A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液.
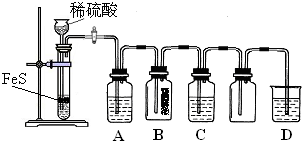
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为
②B中的现象是
③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为
④D中盛放的试剂可以是
a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
已知:电离平衡常数:H2S Ka1=1.3×10-7;Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在
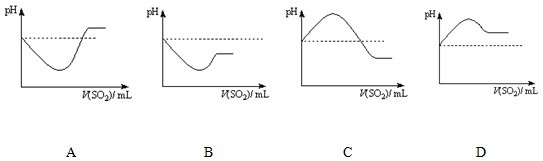
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
查看习题详情和答案>>
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |

回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为
H2S+CuSO4=CuS↓+H2SO4
H2S+CuSO4=CuS↓+H2SO4
.②B中的现象是
蓝色石蕊试纸变红
蓝色石蕊试纸变红
.③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为
H2S+2Fe3+=S↓+2H++2Fe2+
H2S+2Fe3+=S↓+2H++2Fe2+
.④D中盛放的试剂可以是
d
d
(填标号).a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在
酸性(或酸性较强)
酸性(或酸性较强)
条件下,+4价硫的化合物可以氧化-2价硫的化合物.②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
C
C
(填序号).
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应
将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应
.