摘要: 对金属元素性质进行归纳总结
网址:http://m.1010jiajiao.com/timu3_id_61805[举报]
①~⑩是元素周期表中的十种元素:
回答下列问题:
(1)某同学对下列性质进行了对比,其中正确的是
A.原子半径:⑩>⑨>⑦
B.离子半径:⑨>④>⑦
C.非金属性:③>②>⑥
D.单质的熔点:④>⑨>⑩>⑧
E.单质的氧化性:③>⑦>⑧
(2)用合适的化学用语回答:
金属性最强的元素离子结构示意图为
 ,常温下呈液态的氢化物的结构式为:
,常温下呈液态的氢化物的结构式为:
(3)在上述元素中,②、⑧元素形成的气态氢化物可以相互反应,该反应的化学方程式为
查看习题详情和答案>>
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(1)某同学对下列性质进行了对比,其中正确的是
CD
CD
.A.原子半径:⑩>⑨>⑦
B.离子半径:⑨>④>⑦
C.非金属性:③>②>⑥
D.单质的熔点:④>⑨>⑩>⑧
E.单质的氧化性:③>⑦>⑧
(2)用合适的化学用语回答:
金属性最强的元素离子结构示意图为


H-O-H
H-O-H
.(3)在上述元素中,②、⑧元素形成的气态氢化物可以相互反应,该反应的化学方程式为
NH3+HCl═NH4Cl
NH3+HCl═NH4Cl
;⑨、⑤元素形成的最高价氧化物的水化物可以相互反应,该反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
.对物质性质进行研究的基本程序是:观察物质的外观性质→预测物质性质→设计实验→观察实验现象
→对实验现象进行分析、解释→得出结论.其中预测物质的性质在整个程序中起到重要的作用.据此,请回答:
钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是( )
→对实验现象进行分析、解释→得出结论.其中预测物质的性质在整个程序中起到重要的作用.据此,请回答:
钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是( )
| A、K的还原性比Na的还原性强 | B、最高价氧化物的水化物的碱性,K比Na弱 | C、K可以被空气中的氧气所氧化,且产物只是K2O | D、K与水能够反应,但不如Na与水反应剧烈,但都可以生成氢气 |
对物质性质进行研究的基本程序是:观察物质的外观性质→预测物质性质→设计实验→观察实验现象→对实验现象进行分析、解释→得出结论.其中预测物质的性质在整个程序中起着重要的作用.据此解答:钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的( )
| A、因为K的活泼性强,所以钾应该保存在煤油中 | B、K在空气可以被氧气氧化,且产物是K2O | C、K 与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气 | D、K可以与水剧烈反应,生成氢气 |
盐酸、硝酸都是用途相当广泛的两种酸.
(1)瑞典科家舍勒在研究软锰矿(主要成份为MnO2)时,将浓盐酸与软锰矿混合加热,产生了一种有刺激性气味的有色气体.写出该反应的化学方程式,并标出电子转移方向和数目:
 .
.
(2)某校合作学习探究小组学习科学家探究精神对氯气性质进行了探究,设计了以下一些实验.
①能说明氯气与水发生化学反应的实验是
②写出实验D中所发生反应的离子方程式
(3)该校另一合作学习探究小组用下列如图1所示装置对铜与硝酸反应进行探究.
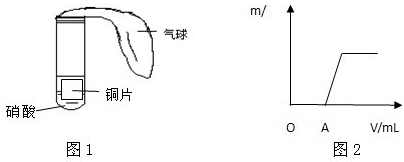
①甲同学观察到试管中的气体由无色变成了红棕色,由此认为试管里的硝酸是浓硝酸,你认为他的看法正确吗?
②乙同学向反应完成后的溶液里滴加氢氧化钠溶液,产生的沉淀(m/g)和加入溶液的体积(V/mL)的关系如图2所示.请写出O-A段反应的离子方程式
查看习题详情和答案>>
(1)瑞典科家舍勒在研究软锰矿(主要成份为MnO2)时,将浓盐酸与软锰矿混合加热,产生了一种有刺激性气味的有色气体.写出该反应的化学方程式,并标出电子转移方向和数目:


(2)某校合作学习探究小组学习科学家探究精神对氯气性质进行了探究,设计了以下一些实验.
| 实验内容 | 实验现象 | |
| A | 收集一集气瓶气体,观察颜色,然后向瓶内倒入约占瓶容积1/5的蒸馏水,充分振荡. | 蒸馏水呈浅黄绿色,瓶内气体仍呈黄绿色. |
| B | 取出瓶内部分溶液,滴入紫色石蕊试液中直至过量. | 紫色石蕊试液先变红色,后红色褪色. |
| C | 取出瓶内剩下的部分溶液,滴入硝酸银溶液中. | 产生大量白色沉淀 |
| D | 最后向瓶内倒入少量浓氢氧化钠溶液,振荡. | 瓶内黄绿色气体立即消失. |
BC
BC
(填实验序号)②写出实验D中所发生反应的离子方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(3)该校另一合作学习探究小组用下列如图1所示装置对铜与硝酸反应进行探究.

①甲同学观察到试管中的气体由无色变成了红棕色,由此认为试管里的硝酸是浓硝酸,你认为他的看法正确吗?
不正确
不正确
.为什么?因为一氧化氮与试管内空气中的氧气反应,也会产生红棕色气体,浓硝酸和铜反应生成的是红棕色二氧化氮气体
因为一氧化氮与试管内空气中的氧气反应,也会产生红棕色气体,浓硝酸和铜反应生成的是红棕色二氧化氮气体
.甲同学还能观察到的现象有气球鼓起胀大,铜片上放出气泡,溶液由无色变成蓝色,铜片变小甚至消失
气球鼓起胀大,铜片上放出气泡,溶液由无色变成蓝色,铜片变小甚至消失
.②乙同学向反应完成后的溶液里滴加氢氧化钠溶液,产生的沉淀(m/g)和加入溶液的体积(V/mL)的关系如图2所示.请写出O-A段反应的离子方程式
H++OH-=H2O
H++OH-=H2O
.(14分)盐酸、硝酸都是用途相当广泛的两种酸。
(1)瑞典科家舍勒在研究软锰矿(主要成份为MnO2)时,将浓盐酸与软锰矿混合加热,产生了一种有刺激性气味的有色气体。写出该反应的化学方程式,并标出电子转移方向和数目: 。
(2)某校合作学习探究小组学习科学家探究精神对氯气性质进行了探究,设计了以下一些实验。
|
| 实验内容 | 实验现象 |
| A | 收集一集气瓶气体,观察颜色,然后向瓶内倒入约占瓶容积1/5的蒸馏水,充分振荡。 | 蒸馏水呈浅黄绿色,瓶内气体仍呈黄绿色。 |
| B | 取出瓶内部分溶液,滴入紫色石蕊试液中直至过量。 | 紫色石蕊试液先变红色,后红色褪色。 |
| C | 取出瓶内剩下的部分溶液,滴入硝酸银溶液中。 | 产生大量白色沉淀 |
| D | 最后向瓶内倒入少量浓氢氧化钠溶液,振荡。 | 瓶内黄绿色气体立即消失。 |
①能说明氯气与水发生化学反应的实验是 (填实验序号)
②写出实验D中所发生反应的离子方程式 。
(3)该校另一合作学习探究小组用下列左图所示装置对铜与硝酸反应进行探究。
①甲同学观察到试管中的气体由无色变成了红棕色,由此认为试管里的硝酸是浓硝酸,你认为他的看法正确吗? 。为什么? 。
甲同学还能观察到的现象有 。
②乙同学向反应完成后的溶液里滴加氢氧化钠溶液,产生的沉淀(m/g)和加入溶液的体积(V/mL)的关系如上右图所示。请写出O-A段反应的离子方程式 。
查看习题详情和答案>>