摘要:100mL 0.1 mol/L CH3COOH与50mL 0.2 mol/L NaOH溶液混合.所得溶液中( ) A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) B.c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-) C.c(Na+)>c(CH3COO-)>c(H+)= c(OH-) D.c(Na+)= c(CH3COO-)>c(OH-)>c(H+)
网址:http://m.1010jiajiao.com/timu3_id_61721[举报]
请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol•L-1的CH3COOH溶液与50mL 0.2mol•L-1的NaOH溶液混合,所得溶液呈 性,原因是 (用离子方程式表示)。
(3)0.1mol·mol-1的氨水溶液中存在电离平衡NH3+H2O 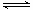 NH3·H2O
NH3·H2O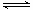 NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
|
|
条件的变化 |
通氨气 |
加水 |
加NH4Cl(s) |
|
① |
电离平衡移动的方向 |
|
|
|
|
② |
c(OH-)的变化 |
|
|
|
[第①行填“向左”、“向右”或“不移动” 第②行填“增大”、“减小”或“不变”]
查看习题详情和答案>>
请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol?L-1的CH3COOH溶液与50mL 0.2mol?L-1的NaOH溶液混合,所得溶液呈 性,原因是 (用离子方程式表示)。
(3)0.1mol·mol-1的氨水溶液中存在电离平衡NH3+H2O  NH3·H2O
NH3·H2O NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
| | 条件的变化 | 通氨气 | 加水 | 加NH4Cl(s) |
| ① | 电离平衡移动的方向 | | | |
| ② | c(OH-)的变化 | | | |
[第①行填“向左”、“向右”或“不移动” 第②行填“增大”、“减小”或“不变”] 查看习题详情和答案>>
请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol?L-1的CH3COOH溶液与50mL 0.2mol?L-1的NaOH溶液混合,所得溶液呈 性,原因是 (用离子方程式表示)。
(3)0.1mol·mol-1的氨水溶液中存在电离平衡NH3+H2O NH3·H2O
NH3·H2O NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
[第①行填“向左”、“向右”或“不移动” 第②行填“增大”、“减小”或“不变”]
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol?L-1的CH3COOH溶液与50mL 0.2mol?L-1的NaOH溶液混合,所得溶液呈 性,原因是 (用离子方程式表示)。
(3)0.1mol·mol-1的氨水溶液中存在电离平衡NH3+H2O
 NH3·H2O
NH3·H2O NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格: | | 条件的变化 | 通氨气 | 加水 | 加NH4Cl(s) |
| ① | 电离平衡移动的方向 | | | |
| ② | c(OH-)的变化 | | | |
[第①行填“向左”、“向右”或“不移动” 第②行填“增大”、“减小”或“不变”]