题目内容
请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol•L-1的CH3COOH溶液与50mL 0.2mol•L-1的NaOH溶液混合,所得溶液呈 性,原因是 (用离子方程式表示)。
(3)0.1mol·mol-1的氨水溶液中存在电离平衡NH3+H2O 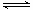 NH3·H2O
NH3·H2O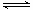 NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
|
|
条件的变化 |
通氨气 |
加水 |
加NH4Cl(s) |
|
① |
电离平衡移动的方向 |
|
|
|
|
② |
c(OH-)的变化 |
|
|
|
[第①行填“向左”、“向右”或“不移动” 第②行填“增大”、“减小”或“不变”]
【答案】
(1)(1分)>
(2)(3分)碱(1分) CH3COO- +H2O 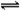 CH3COOH+OH-
(2分)
CH3COOH+OH-
(2分)
(3)
|
条件的变化 |
通氨气 |
加水 |
加NH4Cl(s) |
|
电离平衡移动的方向 |
向右 |
向右 |
|
|
c(OH-)的变化 |
|
减小 |
减小 |
【解析】
试题分析:⑴弱酸与强酸在稀释相同倍数时,强酸的变化比弱酸的变化程度大,因此稀释后溶液的pH:盐酸>醋酸;⑵刚好生成醋酸钠,是一种强碱弱酸盐,水解显碱性;⑶遵循平衡移动原理。
考点:考查化学平衡及其移动。

练习册系列答案
相关题目
 液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液.请回答下列问题:
液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液.请回答下列问题: ((Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
((Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题: