题目内容
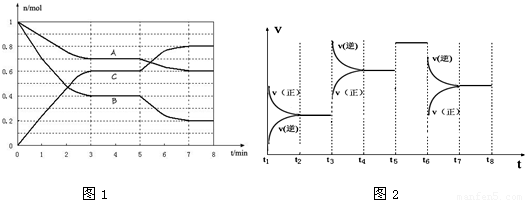
25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如下图1所示.已知达平衡后,降低温度,A的转化率将增大.

(1)从反应开始到达第一次平衡时的平均速率v(A)为
(2)根据上图数据,写出该反应的化学方程式
(3)在5~7min内,若K值不变,则此处曲线变化的原因是
(4)下图2表示此反应的反应速率v和时间t的关系图,根据上图判断,在t3和t5时刻改变的外界条件分别是

(1)从反应开始到达第一次平衡时的平均速率v(A)为
0.05mol/(L?min)
0.05mol/(L?min)
.(2)根据上图数据,写出该反应的化学方程式
A+2B?2C
A+2B?2C
;求出此反应在25℃的平衡常数K=6.43L/mol
6.43L/mol
(保留2位小数).(3)在5~7min内,若K值不变,则此处曲线变化的原因是
增大压强
增大压强
.(4)下图2表示此反应的反应速率v和时间t的关系图,根据上图判断,在t3和t5时刻改变的外界条件分别是
升高温度
升高温度
和加入催化剂
加入催化剂
;A的转化率最大的一段时间是t2~t3
t2~t3
.分析:(1)根据v=
计算v(A);
(2)随反应进行,反应物的物质的量减小,生成物的物质的量增加,由图可知A、B为反应物,C为生产物,且最后A、B的物质的量不为0,为可逆反应,根据物质的量之比等于化学计量数之比书写方程式;
化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
(3)K值不变,温度不变,由图1可知,5min时各组分的物质的量不变,且平衡向正反应移动,只能改变压强;
(4)降低温度,A的转化率将增大,反应向正反应进行,所以正反应为放热反应,再结合反应前后气体体积变化分析;
t3时刻,正逆反应速率都增大,且逆反应速率变化大,平衡向逆反应移动;
t6时刻,正逆反应速率都减小,且正反应速率变化大,平衡向逆反应移动.
| △c |
| △t |
(2)随反应进行,反应物的物质的量减小,生成物的物质的量增加,由图可知A、B为反应物,C为生产物,且最后A、B的物质的量不为0,为可逆反应,根据物质的量之比等于化学计量数之比书写方程式;
化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
(3)K值不变,温度不变,由图1可知,5min时各组分的物质的量不变,且平衡向正反应移动,只能改变压强;
(4)降低温度,A的转化率将增大,反应向正反应进行,所以正反应为放热反应,再结合反应前后气体体积变化分析;
t3时刻,正逆反应速率都增大,且逆反应速率变化大,平衡向逆反应移动;
t6时刻,正逆反应速率都减小,且正反应速率变化大,平衡向逆反应移动.
解答:解:(1)从反应开始到达第一次平衡时的平均速率v(A)=
=0.05mol/(L?min),
故答案为:0.05mol/(L?min);
(2)由图1可知,A、B为反应物,C为生产物,且最后A、B的物质的量不为0,为可逆反应,3min时△n(A):△n(B):△n(C)=(1-0.7)mol:(1-0.4)mol:0.6mol=1:2:2,物质的量之比等于化学计量数之比,所以反应方程式为A+2B?2C;
该反应达到平衡状态时,c(C)=
=0.3mol/L,C(A)=
mol/L=0.35mol/L,c(B)=
mol/L=0.2mol/L,
k=
L/mol=6.43 L/mol,
故答案为:A+2B?2C,6.43 L/mol;
(3)K值不变,温度不变,由图1可知,5min时各组分的物质的量不变,且平衡向正反应移动,只能改变压强,
由反应为前后气体体积减小的反应,故应增大压强,故答案为:增大压强;
(4)t3时刻,正逆反应速率都增大,且逆反应速率变化大,平衡向逆反应移动,应为升高温度;
t5时刻,正逆反应速率都增大且相等,平衡不移动,该反应前后气体体积改变,则改变的条件是加入催化剂,
t3和t5时刻平衡向逆反应方向移动,所以t2~t3段A的转化率最高,
故答案为:升高温度,使用催化剂,t2~t3 .
| ||
| 3min |
故答案为:0.05mol/(L?min);
(2)由图1可知,A、B为反应物,C为生产物,且最后A、B的物质的量不为0,为可逆反应,3min时△n(A):△n(B):△n(C)=(1-0.7)mol:(1-0.4)mol:0.6mol=1:2:2,物质的量之比等于化学计量数之比,所以反应方程式为A+2B?2C;
该反应达到平衡状态时,c(C)=
| 0.6mol |
| 2L |
| 0.7 |
| 2 |
| 0.4 |
| 2 |
k=
| 0.3×0.3 |
| 0.35×0.2×0.2 |
故答案为:A+2B?2C,6.43 L/mol;
(3)K值不变,温度不变,由图1可知,5min时各组分的物质的量不变,且平衡向正反应移动,只能改变压强,
由反应为前后气体体积减小的反应,故应增大压强,故答案为:增大压强;
(4)t3时刻,正逆反应速率都增大,且逆反应速率变化大,平衡向逆反应移动,应为升高温度;
t5时刻,正逆反应速率都增大且相等,平衡不移动,该反应前后气体体积改变,则改变的条件是加入催化剂,
t3和t5时刻平衡向逆反应方向移动,所以t2~t3段A的转化率最高,
故答案为:升高温度,使用催化剂,t2~t3 .
点评:本题考查化学平衡移动图象题,题目难度较大,注意从图2判断各阶段的影响因素是解答该题的关键.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
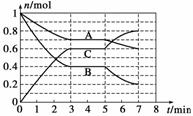 25 ℃时,在体积为2 L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如下图所示,已知达平衡后,降低温度,A的转化率将增大。
25 ℃时,在体积为2 L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如下图所示,已知达平衡后,降低温度,A的转化率将增大。
(1)根据上图数据,写出该反应的化学方程式:___________________;
此反应的平衡常数表达式K= ,从反应开始到达第一次平衡时的平均速率v(A)为 。
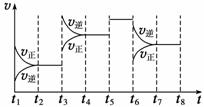 (2)在5~7 min内,若K值不变,则此处曲线变化的原因是 。
(2)在5~7 min内,若K值不变,则此处曲线变化的原因是 。
(3)下图表示此反应的反应速率v和时间t的关系图:
各阶段的平衡常数如下表所示:
| t2-t3 | t4-t5 | t5-t6 | t7-t8 |
| K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为_____________________________________________
(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是 。
25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如图1所示.已知达平衡后,降低温度,A的转化率将增大.
(1)根据图1数据,写出该反应的化学方程式 ;此反应的平衡常数表达式K= .从反应开始到达第一次平衡时的平均速率v(A)为 .
(2)在5~7min内,若K值不变,则此处曲线变化的原因是 .
(3)图2表示此反应的反应速率v和时间t的关系图.
各阶段的平衡常数如下表所示:
根据图2判断,在t3和t6时刻改变的外界条件分别是 和 ;K1、K2、K3、K4之间的关系为: (用“>”、<”或“=”连接).A的转化率最大的一段时间是 .

(1)根据图1数据,写出该反应的化学方程式 ;此反应的平衡常数表达式K= .从反应开始到达第一次平衡时的平均速率v(A)为 .
(2)在5~7min内,若K值不变,则此处曲线变化的原因是 .
(3)图2表示此反应的反应速率v和时间t的关系图.
各阶段的平衡常数如下表所示:
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |

 2C
2C