网址:http://m.1010jiajiao.com/timu3_id_61[举报]
【分析】氢氧化钠溶液变质的原因是
【提出问题】该氢氧化钠溶液是全部变质还是部分变质?
【查阅资料】①已知反应:BaCl2+Na2CO3═2NaCl+BaCO3↓(白色)
②氯化钡溶液呈中性.
【设计实验】依据查阅的资料设计实验步骤,并进行实验,根据实验现象推断相应实验结论.
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量氯化钡溶液,并不断振荡. | 有白色沉淀产生. | 说明原溶液中一定含有 Na2CO3 Na2CO3 . |
| (2)取(1)试管中的上层清液滴加酚酞试液. | 溶液变红色. | 则溶液中一定含有 NaOH NaOH . |
【进一步实验】该小组同学用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验.请你帮助他们解决下列问题:
(1)除去氢氧化钠溶液中存在的上述杂质可加入适量的
(2)借助于
【研究课题2】取25.2g氢氧化钠样品(杂质为碳酸钠)溶于水配制成46g溶液,再加入74g溶质质量分数为20%的氢氧化钙溶液,恰好完全反应.求:反应后所得溶液中溶质的质量分数.
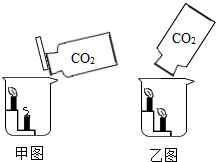 化学兴趣小组的同学对碳及碳的氧化物进行了一系列拓展性探究学习.
化学兴趣小组的同学对碳及碳的氧化物进行了一系列拓展性探究学习.【探究一】二氧化碳的性质的拓展探究
(1)倾倒二氧化碳实验
甲、乙两同学将两瓶完全相同的足够的二氧化碳气体,分别以甲图、乙图的方式将二氧化碳气体慢慢倒入烧杯中,请分析回答:
①甲同学用甲图的方式倾倒,观察到两根蜡烛是由下而上熄灭,该实验说明二氧化碳具有
②乙同学用乙图的方式倾倒,观察到的结果是两根蜡烛都没有熄灭,请你联系学科知识分析,蜡烛没有熄灭的原因
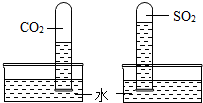
(2)二氧化碳与二氧化硫溶解性对比实验
丙同学用相同的试管分别收集了二氧化碳和二氧化硫,做了如右图所示的对比实验,现象如图.分析该现象得到的结论是
【探究二】在学习了木炭还原氧化铜的实验后,小明对课本上实验进行如下改进:
将CuO和足量炭粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按图连接仪器(加热装置和固定装置省略,下同).
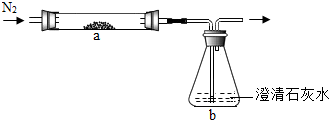
实验开始时缓慢通入氮气,过一段时间后,加热反应管a,观察到管内有红色固体产生,b瓶的溶液中出现白色浑浊.待反应完全后,停止加热,仍继续通氮气,直至反应管冷却.根据以上叙述回答问题:
(1)通N2的目的是
(2)写出b瓶中发生反应的化学方程式
(3)停止加热前是否需要先断开a和b的连接处?
(4)小梅认为:木炭与氧化铜反应产生的气体中既有CO2,又有CO.为验证此猜想,小梅对上述装置做了如下改进并实验:
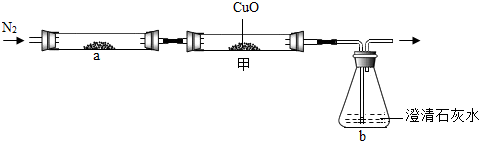
小梅观察到
小明认为小梅的实验不能证明木炭与氧化铜反应产生了CO2,其理由是
某化学兴趣小组的同学在课外读物中看到:“通常CO2可做灭火剂,但有些物质(如Na)着火,不能用CO2熄灭。”他们决定探究CO2与 Na反应的产物。
⑴提出猜想:CO2与 Na反应可能生成四种物质:C、CO、Na2O、Na2CO3。
⑵查阅资料:
①Na是非常活泼的金属,在常温下能与O2、H2O等物质反应。
②碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应;
③Na2O是白色固体,与H2O反应生成NaOH;
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀。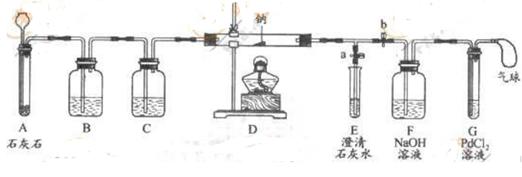
⑶实验过程:同学们在老师的指导下设计了如图所示的装置(夹持仪器已略去)
①实验记录:
| 序号 | 实验操作 | 主要实验现象 | 试验结论及解释 |
| Ⅰ | 打开a,关闭b,由长颈漏斗向A中注入稀盐酸 | A中产生大量气泡,E中出现浑浊 | E中反应的化学方程式为 |
| Ⅱ | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中的Na剧烈燃烧,产生白烟,内壁附有黑色、白色固体;G中产生黑色沉淀 | 反应的产物中一定有 和 |
| Ⅲ | 将D中白色固体加入试管中,加水溶解,再加入澄清石灰水 | 产生白色沉淀 | 反应的产物中还有 |
Ⅰ.实验记录Ⅱ中,E中出现浑浊后埔再点燃酒精灯的目的是
Ⅱ.若无装置C,对实验有影响的物质是 。
Ⅲ.检验第四种物质是否存在的实验方案:将D中白色固体加入试管中,
。 查看习题详情和答案>>
某化学兴趣小组的同学在课外读物中看到:“通常CO2可做灭火剂,但有些物质(如Na)着火,不能用CO2熄灭 。”他们决定探究CO2与 Na反应的产物。
⑴提出猜想:CO2与 Na反应可能生成四种物质:C、CO、Na2O、Na2CO3。
⑵查阅资料:
①Na是非常活泼的金属,在常温下能与O2、H2O等物质反应。
②碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应;
③Na2O是白色固体,与H2O反应生成NaOH;
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀。
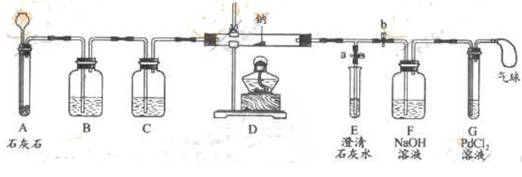
⑶实验过程:同学们在老师的指导下设计了如图所示的装置(夹持仪器已略去)
①实验记录:
|
序号 |
实验操作 |
主要实验现象 |
试验结论及解释 |
|
Ⅰ |
打开a,关闭b,由长颈漏斗向A中注入稀盐酸 |
A中产生大量气泡,E中出现浑浊 |
E中反应的化学方程式为
|
|
Ⅱ |
当E中出现浑浊时,打开b,关闭a,点燃酒精灯 |
D中的Na剧烈燃烧,产生白烟,内壁附有黑色、白色固体;G中产生黑色沉淀 |
反应的产物中一定有 和 |
|
Ⅲ |
将D中白色固体加入试管中,加水溶解,再加入澄清石灰水 |
产生白色沉淀 |
反应的产物中还有
|
②实验反思:
Ⅰ.实验记录Ⅱ中, E中出现浑浊后埔再点燃酒精灯的目的是
Ⅱ.若无装置C,对实验有影响的物质是 。
Ⅲ.检验第四种物质是否存在的实验方案:将D中白色固体加入试管中,
。
查看习题详情和答案>>
【研究课题】食品保鲜袋的元素组成.
【查阅资料】碱石灰是由NaOH和CaO组成的吸湿剂;无水硫酸铜可作吸水剂,且吸水后由白色变为蓝色.
【提出猜想】保鲜袋可能由“碳、氢、氧”中的两种或三种元素组成.
【实验设计】小组同学设计了如下实验装置,利用燃烧法测定保鲜袋的元素组成.
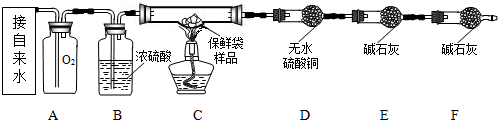
【实验步骤】
(1)按上图图示连接好仪器.
(2)检查装置的气密性.
(3)按图示装好药品和1.4g剪碎的保鲜袋样品,除D、E、F外将仪器按原图组装.
(4)向A中缓慢注水一段时间后,将已称重的D、E两干燥管和未称重的F干燥管接到C的尾端.
(5)点燃C处的酒精灯,直至保鲜袋子碎片完全燃烧.
(6)熄灭酒精灯并继续向A中注水一段时间.
(7)分别对D、E进行第2次称重.
【实验分析】
(1)B处的浓硫酸的作用是
(2)在点燃酒精灯前,要向A中缓慢注水一段时间是为了
(3)熄灭酒精灯后继续向A中注水一段时间是为了
(实验结论)第1次对D、E称重质量分别为54.2g、48.0g;第2次对D、E称重质量分别为56.0g、52.4g,则该食品保鲜袋的元素组成为